EQUILIBRIO QUÍMICO EN LAS REACCIONES COTIDIANAS DE INTERÉS TECNOLÓGICO Y EL EQUILIBRIO IÓNICO PRODUCTO DE SOLUBILIDAD EN EL ANÁLISIS DEL AGUA PARA CONSUMO HUMANO
1. El estado de equilibrio y cálculo de la constante de equilibrio
El estado de equilibrio Químico
Después de haber visto los aspectos energéticos y cinéticos de las reacciones químicas, sabes que el carácter exotérmico y el aumento de la entropía favorecen la espontaneidad de los procesos, y que puedes conseguir que una reacción se produzca de forma más rápida o más lenta, según sea lo que te interese.
También sabes que si una reacción es espontánea no quiere
decir que se produzca totalmente, y que si no es espontánea no se produzca en
absoluto: cuanto menor sea ΔG de la reacción, mayor será su grado de reacción,
de manera que si es un valor muy positivo, el proceso prácticamente no se
producirá y el grado de reacción será nulo (0%). Y, al revés, si es un valor
muy negativo, la reacción se producirá totalmente, con un grado de reacción del
100%.
Por esta razón, las reacciones pueden ser irreversibles o reversibles
En las irreversibles, los reactivos, R, se transforman totalmente en productos, P, y si se mezclan productos no se transforman en reactivos. Es decir, el grado de reacción de R en P es del 100%, y el de P en R del 0%. En la reacción se indica con una flecha en el sentido de la transformación. Fíjate en que en el sentido de R en P la variación de entalpía libre es muy negativa, por lo que en el sentido contrario, de P en R, será muy positiva, y la transformación no se producirá. Éste es el tipo de reacciones con el que has trabajado hasta ahora al realizar cálculos estequiométricos
En las reacciones reversibles, los reactivos se transforman en productos, pero no lo hacen totalmente, quedando una cantidad más o menos apreciable de reactivos sin transformarse, con lo que el grado de reacción es un valor entre el 0% y el 100%. Además, si partes de una mezcla de productos, también se transforman en parte en reactivos, y en todos los casos se llega a una situación en la que la composición de la mezcla de reactivos y productos ya no cambia, que se conoce como estado de equilibrio químico. Como la reacción se produce apreciablemente en los dos sentidos, se indica con una doble flecha.
Con este tipo de reacciones vas a trabajar hasta final de curso. En esta
unidad trabajarás en primer lugar con equilibrios en los que
intervienen únicamente gases o sustancias en disolución, para pasar
después a sistemas heterogéneos, sobre todo con sustancias iónicas que
se disuelven, mientras que en la unidad siguiente verás procesos en
disolución entre sustancias ácidas y básicas.
Es más fácil analizar en primer lugar lo que sucede en procesos físicos. Uno de los casos más interesantes es el paso al estado gaseoso de sólidos o líquidos. En la simulación siguiente puedes observar lo que sucede cuando sublima el yodo sólido, generando un vapor violeta.
Al principio, no hay más que yodo sólido. Poco a poco, se va observando la formación de un gas coloreado, y al cabo de unos veinte minutos la intensidad del color ya no aumenta. Parece lógico suponer que ya no se forma más vapor de yodo, por lo que tampoco cambiará la masa de yodo sólido ni la presión en el matraz. Esa situación en la que no cambian las propiedades del sistema es el estado de equilibrio.
Fíjate en lo que sucede si se parte de una masa mayor de gas. En los
equilibrios gaseosos solamente influye la cantidad de sustancias en ese
estado, no la de sólido.
Es muy importante la interpretación que se hace del hecho de que la
composición de la mezcla en equilibrio no varíe. Una posible explicación
sería que la reacción se detuviese, pero lo que se propone es que el
sólido sigue evaporándose, pero a la vez el vapor condensa, de manera
que ambos procesos se realizan a la misma velocidad, con lo que las
cantidades de yodo en los dos estados no cambian. Es decir, el equilibrio es dinámico.
Más información acerca de equilibrio Químico....
La constante de equilibrio
Las reacciones químicas que transcurren en un recipiente cerrado pueden alcanzar un estado de equilibrio que se caracteriza porque las concentraciones de los reactivos y de los productos permanecen inalteradas a lo largo del tiempo. Es decir, bajo determinadas condiciones de presión y temperatura la reacción no progresa más y se dice que ha alcanzado el estado de equilibrio.
Expresión de la constante de equilibrio
La constante de equilibrio (K) se expresa como la relación entre las concentraciones molares (mol/l) de reactivos y productos. Su valor en una reacción química depende de la temperatura, por lo que ésta siempre debe especificarse. La expresión de una reacción genérica es:
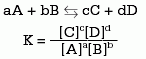
En el numerador se escribe el producto de las concentraciones de los productos y en el denominador el de los reactivos. Cada término de la ecuación se eleva a una potencia cuyo valor es el del coeficiente estequiométrico en la ecuación ajustada.
La constante de equilibrio: Kc o Kp
Cuando se trata de mezclas gaseosas, a veces resulta más adecuado describir la composición en términos de presiones parciales. Para ello hay que adaptar la expresión de la constante de equilibrio y referirla, en vez de a concentraciones Kc, a presiones parciales Kp.
Kp y Kc se relacionan mediante la ley de los gases ideales, de forma que conocida una puede conocerse la otra:
PV = nRT Þ P = (n/V) RT Þ P = cRT
Para cada componente del equilibrio se puede escribir una ecuación similar, de tal forma que en el siguiente ejemplo puede deducirse que:
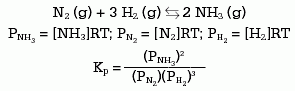
Generalizando:
Kp = Kc (RT)Dn
de manera que Dn es la variación del número de moles en la ecuación. Se representa como la diferencia entre el número de moles de gas en los productos y el número de moles de gas en los reactivos:
Dn = ngas (productos) - ngas (reactivos)
Magnitud de la constante de equilibrio
La magnitud de la constante de equilibrio informa sobre el estado de equilibrio, es decir, sobre la extensión con que una reacción química se lleva a cabo.
Si la constante de equilibrio para una reacción química (Kp o Kc) tiene un valor muy grande, el grado de conversión de reactivos a productos es muy alto. Por el contrario, valores numéricos de Kp o Kc muy pequeños indican que el grado de conversión de reactivos a productos es muy pequeño.
Por ejemplo, en las siguientes reacciones, que transcurren ambas a 298 K:
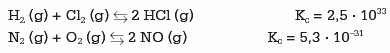
El valor alto de Kc para la primera ecuación indica que prácticamente toda la cantidad de reactivos se ha convertido en productos.
Por el contrario, el valor bajo de Kc para la segunda ecuación indica que la cantidad de reactivos que se ha convertido en productos es muy baja.
Cociente de reacción
El cociente de reacción se designa con la letra Q y coincide con la expresión de la constante de equilibrio, pero con la diferencia de que puede ser evaluado en cualquier instante de la reacción y para cualquier valor de las concentraciones de los reactivos y/o de los productos. No es necesario el estado de equilibrio para calcular el valor de Q.
Para la reacción:
![]()
pueden darse las siguientes situaciones:
- Si Q = Kc, el sistema esta en equilibrio.
- Si Q ¹? Kc,
el sistema evolucionará hacia el estado de equilibrio. Para saber en
que sentido evolucionará la reacción es necesario comparar los valores
de ambos:
- Si Q < Kc, significa que el cociente de las concentraciones iniciales es menor que el que debería ser en el equilibrio. El modo de alcanzar el equilibrio es incrementar la concentración de HI (g), ya que asi se reducen las de H2 (g) y I2 (g). La reacción directa se produce con mayor extensión que la inversa, hasta que se alcanza el equilibrio.
- Si Q > Kc, el valor del cociente de las concentraciones iniciales es superior al que corresponde al estado de equilibrio. La reacción inversa se produce con mayor extensión que la directa, hasta que el valor de Q se iguala con Kc.