EQUILIBRIO QUÍMICO EN LAS REACCIONES COTIDIANAS DE INTERÉS TECNOLÓGICO Y EL EQUILIBRIO IÓNICO PRODUCTO DE SOLUBILIDAD EN EL ANÁLISIS DEL AGUA PARA CONSUMO HUMANO
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 6° - Ciencias Naturales: Química |
| Libro: | EQUILIBRIO QUÍMICO EN LAS REACCIONES COTIDIANAS DE INTERÉS TECNOLÓGICO Y EL EQUILIBRIO IÓNICO PRODUCTO DE SOLUBILIDAD EN EL ANÁLISIS DEL AGUA PARA CONSUMO HUMANO |
| Impreso por: | Invitado |
| Fecha: | lunes, 7 de abril de 2025, 12:16 |
Tabla de Contenidos
- 1. El estado de equilibrio y cálculo de la constante de equilibrio
- 2. Aplicación de la Ley de Chatelier al estudio de la vida en las alturas
- 3. Composición de mezclas en equilibrio químico
- 4. Factores que afectan el equilibrio de las reacciones químicas
- 5. Ácidos fuertes y débiles en sustancias de uso diario
- 6. Autoionización del agua y cálculos de pH
- 7. Titulación de ácidos y bases de uso cotidiano
- 8. Cálculos de solubilidad y producto de solubilidad
1. El estado de equilibrio y cálculo de la constante de equilibrio
El estado de equilibrio Químico
Después de haber visto los aspectos energéticos y cinéticos de las reacciones químicas, sabes que el carácter exotérmico y el aumento de la entropía favorecen la espontaneidad de los procesos, y que puedes conseguir que una reacción se produzca de forma más rápida o más lenta, según sea lo que te interese.
También sabes que si una reacción es espontánea no quiere
decir que se produzca totalmente, y que si no es espontánea no se produzca en
absoluto: cuanto menor sea ΔG de la reacción, mayor será su grado de reacción,
de manera que si es un valor muy positivo, el proceso prácticamente no se
producirá y el grado de reacción será nulo (0%). Y, al revés, si es un valor
muy negativo, la reacción se producirá totalmente, con un grado de reacción del
100%.
Por esta razón, las reacciones pueden ser irreversibles o reversibles
En las irreversibles, los reactivos, R, se transforman totalmente en productos, P, y si se mezclan productos no se transforman en reactivos. Es decir, el grado de reacción de R en P es del 100%, y el de P en R del 0%. En la reacción se indica con una flecha en el sentido de la transformación. Fíjate en que en el sentido de R en P la variación de entalpía libre es muy negativa, por lo que en el sentido contrario, de P en R, será muy positiva, y la transformación no se producirá. Éste es el tipo de reacciones con el que has trabajado hasta ahora al realizar cálculos estequiométricos
En las reacciones reversibles, los reactivos se transforman en productos, pero no lo hacen totalmente, quedando una cantidad más o menos apreciable de reactivos sin transformarse, con lo que el grado de reacción es un valor entre el 0% y el 100%. Además, si partes de una mezcla de productos, también se transforman en parte en reactivos, y en todos los casos se llega a una situación en la que la composición de la mezcla de reactivos y productos ya no cambia, que se conoce como estado de equilibrio químico. Como la reacción se produce apreciablemente en los dos sentidos, se indica con una doble flecha.
Con este tipo de reacciones vas a trabajar hasta final de curso. En esta
unidad trabajarás en primer lugar con equilibrios en los que
intervienen únicamente gases o sustancias en disolución, para pasar
después a sistemas heterogéneos, sobre todo con sustancias iónicas que
se disuelven, mientras que en la unidad siguiente verás procesos en
disolución entre sustancias ácidas y básicas.
Es más fácil analizar en primer lugar lo que sucede en procesos físicos. Uno de los casos más interesantes es el paso al estado gaseoso de sólidos o líquidos. En la simulación siguiente puedes observar lo que sucede cuando sublima el yodo sólido, generando un vapor violeta.
Al principio, no hay más que yodo sólido. Poco a poco, se va observando la formación de un gas coloreado, y al cabo de unos veinte minutos la intensidad del color ya no aumenta. Parece lógico suponer que ya no se forma más vapor de yodo, por lo que tampoco cambiará la masa de yodo sólido ni la presión en el matraz. Esa situación en la que no cambian las propiedades del sistema es el estado de equilibrio.
Fíjate en lo que sucede si se parte de una masa mayor de gas. En los
equilibrios gaseosos solamente influye la cantidad de sustancias en ese
estado, no la de sólido.
Es muy importante la interpretación que se hace del hecho de que la
composición de la mezcla en equilibrio no varíe. Una posible explicación
sería que la reacción se detuviese, pero lo que se propone es que el
sólido sigue evaporándose, pero a la vez el vapor condensa, de manera
que ambos procesos se realizan a la misma velocidad, con lo que las
cantidades de yodo en los dos estados no cambian. Es decir, el equilibrio es dinámico.
Más información acerca de equilibrio Químico....
La constante de equilibrio
Las reacciones químicas que transcurren en un recipiente cerrado pueden alcanzar un estado de equilibrio que se caracteriza porque las concentraciones de los reactivos y de los productos permanecen inalteradas a lo largo del tiempo. Es decir, bajo determinadas condiciones de presión y temperatura la reacción no progresa más y se dice que ha alcanzado el estado de equilibrio.
Expresión de la constante de equilibrio
La constante de equilibrio (K) se expresa como la relación entre las concentraciones molares (mol/l) de reactivos y productos. Su valor en una reacción química depende de la temperatura, por lo que ésta siempre debe especificarse. La expresión de una reacción genérica es:
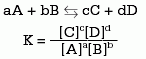
En el numerador se escribe el producto de las concentraciones de los productos y en el denominador el de los reactivos. Cada término de la ecuación se eleva a una potencia cuyo valor es el del coeficiente estequiométrico en la ecuación ajustada.
La constante de equilibrio: Kc o Kp
Cuando se trata de mezclas gaseosas, a veces resulta más adecuado describir la composición en términos de presiones parciales. Para ello hay que adaptar la expresión de la constante de equilibrio y referirla, en vez de a concentraciones Kc, a presiones parciales Kp.
Kp y Kc se relacionan mediante la ley de los gases ideales, de forma que conocida una puede conocerse la otra:
PV = nRT Þ P = (n/V) RT Þ P = cRT
Para cada componente del equilibrio se puede escribir una ecuación similar, de tal forma que en el siguiente ejemplo puede deducirse que:
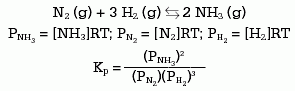
Generalizando:
Kp = Kc (RT)Dn
de manera que Dn es la variación del número de moles en la ecuación. Se representa como la diferencia entre el número de moles de gas en los productos y el número de moles de gas en los reactivos:
Dn = ngas (productos) - ngas (reactivos)
Magnitud de la constante de equilibrio
La magnitud de la constante de equilibrio informa sobre el estado de equilibrio, es decir, sobre la extensión con que una reacción química se lleva a cabo.
Si la constante de equilibrio para una reacción química (Kp o Kc) tiene un valor muy grande, el grado de conversión de reactivos a productos es muy alto. Por el contrario, valores numéricos de Kp o Kc muy pequeños indican que el grado de conversión de reactivos a productos es muy pequeño.
Por ejemplo, en las siguientes reacciones, que transcurren ambas a 298 K:
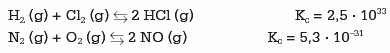
El valor alto de Kc para la primera ecuación indica que prácticamente toda la cantidad de reactivos se ha convertido en productos.
Por el contrario, el valor bajo de Kc para la segunda ecuación indica que la cantidad de reactivos que se ha convertido en productos es muy baja.
Cociente de reacción
El cociente de reacción se designa con la letra Q y coincide con la expresión de la constante de equilibrio, pero con la diferencia de que puede ser evaluado en cualquier instante de la reacción y para cualquier valor de las concentraciones de los reactivos y/o de los productos. No es necesario el estado de equilibrio para calcular el valor de Q.
Para la reacción:
![]()
pueden darse las siguientes situaciones:
- Si Q = Kc, el sistema esta en equilibrio.
- Si Q ¹? Kc,
el sistema evolucionará hacia el estado de equilibrio. Para saber en
que sentido evolucionará la reacción es necesario comparar los valores
de ambos:
- Si Q < Kc, significa que el cociente de las concentraciones iniciales es menor que el que debería ser en el equilibrio. El modo de alcanzar el equilibrio es incrementar la concentración de HI (g), ya que asi se reducen las de H2 (g) y I2 (g). La reacción directa se produce con mayor extensión que la inversa, hasta que se alcanza el equilibrio.
- Si Q > Kc, el valor del cociente de las concentraciones iniciales es superior al que corresponde al estado de equilibrio. La reacción inversa se produce con mayor extensión que la directa, hasta que el valor de Q se iguala con Kc.
2. Aplicación de la Ley de Chatelier al estudio de la vida en las alturas
El Mal de Montaña es una Cuestión de Equilibrio
En el cuerpo humano es necesario mantener innumerables equilibrios químicos para asegurar su bienestar fisiológico.
Un equilibrio químico es una reacción que nunca llega a completarse, (lo indica la doble fecha) se producen cambios tanto en reactivos como en productos de manera simultánea, es un equilibrio dinámico. Cuando las concentraciones de cada una de las sustancias que intervienen (reactivos y productos) se estabiliza, es decir, se gastan a la misma velocidad que se forman.
Por ejemplo:
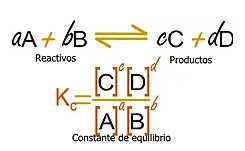
Este equilibrio lo rige un principio llamado “Principio de Le Chatelier” que indica lo siguiente: Cuando hay un sistema en equilibrio o que tienda al equilibrio, si hay alguna perturbación (cambio de concentración, presión o temperatura) en los reactivos o productos, el equilibrio responde de tal manera que tiende a contrarrestar la tensión aplicada. Por ejemplo, en la reacción anterior, si aumentamos la concentración de los reactivos (A o B) el equilibrio responde desplazándose a la derecha, hacia los productos (B y C), aumentando su concentración. Si por el contrario disminuimos la concentración de los reactivos (A o B) el equilibrio se desplaza a la izquierda, hacia los reactivos, disminuyendo la concentración de los productos (C y D). Lo mismo ocurre si alteramos los productos (C o D).
La fisiología del cuerpo humano está muy influida por las condiciones del medio ambiente. Si las condiciones ambientales cambian, el cuerpo se debe adaptar para mantener un funcionamiento adecuado. Las consecuencias de un cambio repentino de altitud ilustran este hecho.
Así, por ejemplo, cuando los alpinistas pretenden escalar montañas como el Everest o el famoso K2, picos de la cordillera del Himalaya, necesitan estar varias semanas aclimatándose a la altitud (al poco oxígeno), pues de lo contrario pueden sufrir fuertes dolores de cabeza, náuseas, cansancio extremo y, en casos graves, la victima puede entrar en coma y sobrevenirle la muerte. Esto se debe a un proceso de hipoxia, que en definitiva no es más que un gran déficit de oxígeno en los tejidos del organismo.
No obstante, los habitantes del lugar pueden vivir normalmente, de ahí que las expediciones vayan siempre acompañadas de sherpas. Sin embargo, una persona que vive a gran altura durante semanas o meses se recupera en forma gradual de la enfermedad de las alturas y se adapta al bajo contenido de oxígeno en la atmósfera, de tal manera que puede funcionar normalmente.
Todo esto se debe a un complicado equilibrio químico que ocurre en el cuerpo humano, el de la respiración y la sangre.
La combinación del oxígeno, O2 que respiramos con la molécula de hemoglobina (Hb), que transporta el oxígeno a través de la sangre a todo el organismo, es una reacción compleja, que a los efectos de esta lectura se puede representar mediante una ecuación simplificada:

Donde HbO2 es la oxihemoglobina, el complejo de hemoglobina y oxígeno que es el que en realidad lleva el oxígeno a los tejidos. La constante de equilibrio es:
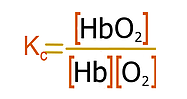
A una altura de 7000 metros la presión parcial del oxígeno es tan solo de 0,07 atm comparada con 0,20 atm al nivel del mar.
De acuerdo con el Principio de Le Chatelier, una disminución en la concentración de oxígeno desplazará el equilibrio de la ecuación hacia la izquierda, es decir hacia una menor producción de oxihemoglobina a los tejidos; que es precisamente este cambio brusco el causante de la hipoxia.
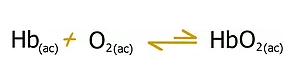
Si por el contrario, le damos el tiempo suficiente de aclimatación a la altura, el organismo puede compensar este cambio brusco produciendo más moléculas de hemoglobina.
El equilibrio anterior se desplazará entonces de forma gradual de nuevo de izquierda a derecha produciendo más moléculas de oxihemoglobina. El aumento de hemoglobina se lleva a cabo muy lentamente y requiere de tres a cuatro semanas para desarrollarse y es probable que se requiera de varios años para regresar a la capacidad plena.
Se ha demostrado que los habitantes de las zonas de gran altitud tienen hasta un 50% más de hemoglobina en sangre que los habitantes de zonas a nivel del mar. Es por ello que los andinos (que viven en zonas altas) tienen las mejillas rosadas, no por el frío, sino por la gran cantidad de hemoglobina.
De la misma manera, análogamente, la selección de fútbol de Bolivia, son casi imbatibles en el estadio de La Paz, ¿el secreto?, éste se encuentra ubicado a 3600 metros de altura sobre el nivel del mar, uno de los más altos del mundo.
Los montañistas necesitan semanas, e incluso meses, para aclimatarse antes de escalar cumbres como la del Monte Everest.
3. Composición de mezclas en equilibrio químico
Composición de mezclas en equilibrio Químico

Más información sobre Composición de mezclas en equilibrio químico
4. Factores que afectan el equilibrio de las reacciones químicas
Factores que afectan el equilibrio químico
De los factores que afectan la velocidad de una reacción, solamente alteran el punto de equilibrio de dicha reacción: la concentración de las sustancias involucradas en la reacción, la presión, cuando reactivos y productos son gases y la temperatura.
Principio de Le Châtelier
A finales del siglo XIX, el químico francés Henry le Châtelier (1850- 1936) postuló que cuando en un sistema en equilibrio se modifica cualquiera de los factores mencionados, se afecta la velocidad de la reacción y el punto de equilibrio se desplaza en la dirección que tienda a contrarrestar el efecto primario de dicha alteración.
Concentración
Cuando la concentración de una de las sustancias en un sistema en equilibrio se cambia, el equilibrio varía de tal forma que pueda compensar este cambio.
Por ejemplo, si se aumenta la concentración de uno de los reaccionantes, el equilibrio se desplaza hacia la derecha o hacia el lado de los productos.
Si se agrega más reactivos (como agregar agua en el lado izquierdo del tubo) la reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio.
Si se remueven los productos (como quitar agua del lado derecho del tubo) La reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio.

Temperatura
La variación de equilibrio causada por un cambio de temperatura dependerá de si la reacción tal como está escrita es exotérmica, o endotérmica.
Reacciones Exotérmicas
Si la reacción es exotérmica se puede considerar al calor como uno de los productos, por lo que al aumentar la temperatura el equilibrio se desplaza hacia la izquierda.
A + B![]() AB + calor
AB + calor
Si se disminuye la temperatura, el equilibrio se desplazará hacia la derecha.
Reacciones Endotérmicas
Si la reacción es endotérmica, el calor se considera como un reactivo.
Por lo tanto, si se aumenta la temperatura se favorece un desplazamiento del equilibrio hacia la derecha y si se disminuye, hacia la izquierda.
Presión
Si se aumenta la presión de un sistema en equilibrio, el equilibrio se desplazará de forma que disminuya el volumen lo máximo posible, es decir, en el sentido que alivie la presión. Como ejemplo, considérese el efecto de triplicar la presión en el siguiente equilibrio:
![]()
Al existir dos volúmenes de gas del lado de los productos, implica que hay una mayor cantidad de moléculas de NO2 y al aumentar la presión se favorece un mayor número de colisiones entre moléculas en el lado de los productos, por lo que el equilibrio se desplaza hacia la izquierda.
Como conclusión a este experimento, observe la siguiente película en donde se confina NO2(g) en una jeringa y se puede observar el cambio de color entre este gas y el N2O4(g) formado.
![]()
Más información sobre factores que afectan el equilibrio en las reacciones quimicas
5. Ácidos fuertes y débiles en sustancias de uso diario
Introducción a los Ácidos
Muchos de nosotros hemos oído hablar del término pH, que en general es la medida de la cantidad de acidez o alcalinidad que hay en una solución. Más específicamente, es una medida de la cantidad de protones o iones de hidrógeno que están presentes en una solución acuosa. Los ácidos son los principales contribuyentes a la medición del pH en una solución, y la presencia de ácidos es una característica clave de casi todas las soluciones, desde la sangre en el cuerpo hasta los alimentos y bebidas que consumimos. Discutamos qué es un ácido y cómo afecta el pH de las soluciones cuando se agrega.
Cómo funcionan los ácidos
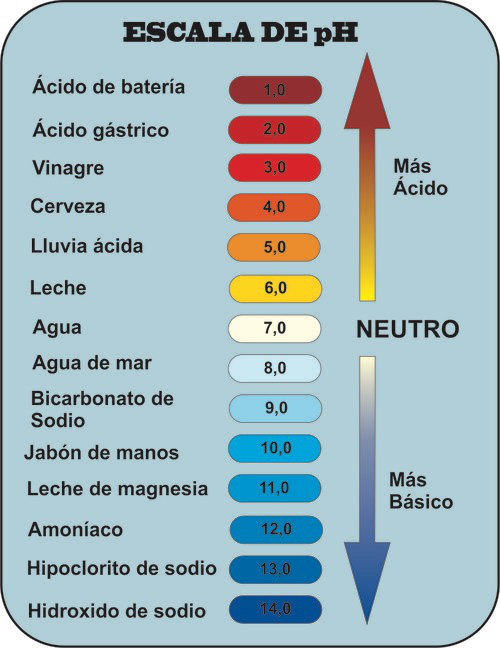
La escala de pH es una escala que se utiliza para representar el nivel de acidez de una solución. Una solución con un pH de 7 es neutra, mientras que una solución con un pH inferior a 7 es un ácido, y una solución con un pH superior a 7 es una base. Un ácido se disocia, o se rompe, y dona protones, o iones de hidrógeno, en una solución acuosa, mientras que una base dona iones de hidróxido en una solución. El agua, por ejemplo, es neutra con un pH de 7. Cuando se añaden los ácidos, liberan más iones de hidrógeno en la solución, y esto hace que el pH de la solución descienda. Permítanme repetirlo: más iones de hidrógeno equivale a un pH más bajo y una solución más ácida.
Ácidos Débiles y Fuertes
Todos los ácidos liberan iones de hidrógeno en soluciones. La cantidad de iones que se liberan por molécula determinará si el ácido es débil o fuerte. Los ácidos débiles son ácidos que liberan parcialmente los átomos de hidrógeno que están unidos. Estos ácidos, entonces, pueden disminuir el pH por disociación de iones de hidrógeno, pero no completamente. Los ácidos débiles incluyen el ácido acético, que es el vinagre, y el ácido cítrico que se encuentra en las naranjas y los limones.
Los ácidos fuertes, por otro lado, se disocian completamente y liberan TODOS sus átomos de hidrógeno. Esto significa que los ácidos fuertes, en general, son más potentes para reducir el pH de una solución. Sólo hay 7 ácidos fuertes, incluyendo el ácido clorhídrico, que se encuentra en el estómago, y el ácido sulfúrico, un ácido corrosivo que se encuentra en cosas como las baterías de los automóviles y los fertilizantes.
Muchas moléculas pueden actuar como ácidos, incluso si no se utilizan principalmente como ácidos. Por ejemplo, el trifosfato de adenosina, o ATP, es una molécula que se utiliza en el cuerpo para producir energía. Pero cuando se agrega a una solución, el ATP también libera iones de hidrógeno, lo que significa que también puede ser considerado un ácido. Asimismo, los aminoácidos, que son los bloques de construcción de las proteínas, también liberan una pequeña cantidad de iones de hidrógeno en soluciones acuosas.
Los ácidos y el cuerpo humano
Una de las mejores maneras de ver los ácidos es a través de sus usos en el cuerpo humano. Muchos de los procesos que están presentes en el cuerpo requieren ácidos para mantenerlos. Los ejemplos incluyen
·
Ácido clorhídrico, que se produce en el estómago
para ayudar en la digestión.
Ácidos grasos, que se liberan cuando el cuerpo descompone las grasas para
obtener energía.
· Aminoácidos, que se utilizan para producir proteínas dentro del cuerpo.
· Ácidos nucleicos, responsables de nuestra composición genética.
Otras características comunes de los ácidos
Existen otras formas comunes de experimentar las características de los ácidos en la vida diaria y en la química. Por ejemplo:
Cambian el papel tornasol azul rojo
Sabor agrio en soluciones acuosas
Pueden formar sales a través de reacciones con algunos metales y bases.
Ejemplos de ácidos
Estos son ejemplos de tipos de ácidos:
Ácido Arrhenius
Ácido de Lewis
ácido clorhídrico
ácido sulfúrico
ácido fluorhídrico
ácido acético
ácido estomacal (que contiene ácido clorhídrico)
vinagre (que contiene ácido acético)
ácido cítrico (encontrado en los cítricos)
Ácidos resumen
Los ácidos son agentes químicos que liberan iones de hidrógeno cuando se añaden al agua. La escala de pH se utiliza para mostrar el nivel de acidez de una solución dada. Cuando se utiliza la escala de pH, más iones de hidrógeno equivalen a un pH más bajo y una solución más ácida. Los ácidos se pueden clasificar como débiles o fuertes, dependiendo de la cantidad de iones de hidrógeno que se disocian cuando el ácido se coloca en el agua. El ácido acético es un ejemplo de un ácido débil, mientras que el ácido clorhídrico, que se encuentra en el estómago, se clasifica como un ácido fuerte.
Los ácidos también juegan un papel importante en el cuerpo humano, como la construcción de proteínas, que están compuestas de aminoácidos. Los ácidos son una característica clave de casi todas las soluciones. Esto incluye soluciones con sabor agrio, el uso de papel de tornasol para probar la acidez y reacciones ácidas que llevan a la formación de sales.
Más ejemplos de acidos fuertes y debiles de uso cotidiano
· ácido sulfúrico (H2SO4)– es un ácido fuerte con gran cantidad de usos, sobre todo en la industria pesada, muy corrosivo e irritante; al diluirse libera mucho calor, por lo que debe manejarse (al igual que los demás ácidos fuertes) con sumo cuidado. Intensamente oxidante.
· ácido clorhídrico (HCl) – pese a que es un ácido fuerte, está presente en el cuerpo humano, concretamente en el estómago, donde cumple una importante función en el proceso digestivo. Su exceso genera acidez estomacal.
· ácido fosfórico (H3PO3) – este ácido es un ingrediente común en las bebidas gasificadas. Se desaconseja el consumo habitual de tales bebidas por el impacto negativo de este ácido en el metabolismo del calcio, lo que afecta huesos y dientes sobre todo.
· ácido nítrico (HNO3) – reconocido ácido fuerte, empleado para fabricar explosivos y fertilizantes nitrogenados, entre otros usos.
· ácido perclórico (HClO4) – otro ácido fuerte que es líquido a temperatura ambiente, es uno de los más oxidantes.
· ácido sulfhídrico (H2S) – es una sustancia gaseosa de fuerte y desagradable olor, tóxico en altas concentraciones, tiene numerosas aplicaciones industriales.
· ácido ribonucleico – es un componente central de los ribosomas, fundamental para que se complete el proceso global de síntesis proteica a partir del ácido desoxirribonucleico, muy relacionado a aquel.
· ácido acetil salicílico – es un ácido orgánico muy importante, con propiedades analgésicas y antiinflamatorias; es la base de la aspirina.
· ácido láctico – proviene de la degradación de la glucosa durante el ejercicio anaeróbico de mucha intensidad y poca duración. En condiciones normales ese ácido láctico se reutiliza, pero si se acumula provoca daño en las fibras musculares, bajo la forma de calambres sobre todo.
· ácido alílico – es un ácido presente en vegetales como el ajo o la cebolla, derivado de un precursor también presente en tales especies, la alicina. Es germicida y antioxidante.
· ácido retinoico – aplicado tópicamente, inhibe la queratinización, se usa en cremas contra el acné y el envejecimiento de la piel. Debe usarse bajo vigilancia médica.
· ácido butírico – producto final de la fermentación de ciertos carbohidratos llevada a cabo por microorganismos del rumen; suele formar parte de las grasas animales en pequeñas cantidades.
· ácido propiónico – conservante alimenticio, se usa con el fin de prevenir el deterioro fúngico y bacteriano de productos de panificación y otros.
· ácido benzoico – se lo usa como conservante adicionado a diferentes productos (mayonesas, productos enlatados), a menudo bajo la forma de sal (benzoato de sodio)
· ácido acético – conservante de alimentos muy usado en el hogar, base de vinagretas y escabeches. Es el componente mayoritario del vinagre.
Más información sobre ácidos y bases en la vida cotidiana...
6. Autoionización del agua y cálculos de pH
Autoionización del agua y cálculos de pH
Medidas de conductividad indican que el agua pura está parcialmente ionizada. Los iones se generan cuando unas moléculas de agua actúan como ácidos cediendo protones a otras moléculas de agua que actúan como bases, según el siguiente equilibrio.![]()
Se trata de una reacción reversible muy desplazada hacia la izquierda. Las cantidades de iones oxonio e hidróxido presentes en el medio es muy pequeña.
La constante de equilibrio de esta reacción se denomina producto iónico del agua,
![]()
En el agua pura las concentraciones de ambos iones es igual: ![]()
Dado que Kw es una constante, en todo momento el producto de las concentraciones de iones oxonio e hidróxido debe ser 10−14.
Por tanto, si añadimos al agua pura un ácido aumentando la
concentración de protones de la disolución, la concentración de iones
hidróxido debe disminuir para mantener el valor de K
Escala de pH
En 1909, el químico danés Soren Sorensen definió el pH como:
![]()
El pH nos da el grado de acidez que presenta una disolución.
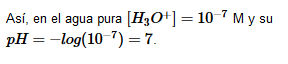
- De modo que consideramos que todas las disoluciones acuosas a 25ºC con pH=7 son neutras.
- Cuando el pH es mayor de 7 la disolución es básica.
- Cuando el pH es menor de 7 la disolución es ácida.
También podemos definir el pOH:
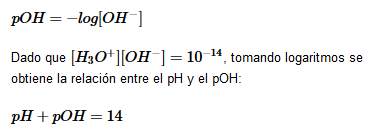
Ver más sobre autoionización del algua y calculos del pH...
This is a modal window.
7. Titulación de ácidos y bases de uso cotidiano
¿Cómo se lleva a cabo una titulación ácido-base?
La titulación, o también conocida como valoración, tiene como objetivo determinar la concentración de una disolución ácida o básica, llamada disolución analizada o muestra problema. Esto se logra adicionando pequeños volúmenes de una disolución de concentración conocida, llamada disolución valorada.
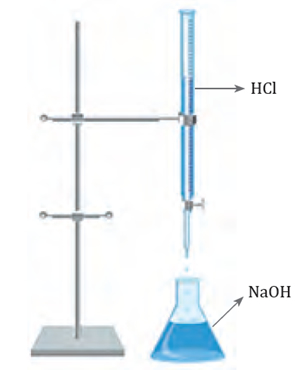
El proceso de titulación se basa en la neutralización que se lleva a cabo entre la disolución ácida y la básica. De esta manera, si se conoce la concentración de iones H+ de la disolución valorada, se puede inferir la concentración de iones OH- de la disolución analizada. Esto se calcula a partir del volumen de disolución valorada utilizado.
En el momento en el que la concentración de H+ y OH- se igualan, se dice que se ha alcanzado el punto de equivalencia. Para determinar este punto, se utiliza un indicador que se caracteriza porque tiene colores diferentes en medio ácido y en medio básico. El punto en que cambia el color de un indicador se llama punto final. Por ende, es necesario elegir un indicador cuyo punto final corresponda o se acerque lo más posible al punto de equivalencia.
El proceso de titulación se representa gráficamente mediante una curva de valoración. Para graficarla es necesario saber el pH de la disolución analizada (eje Y) luego de la adición de pequeñas cantidades de volumen de la disolución valorada (eje X)
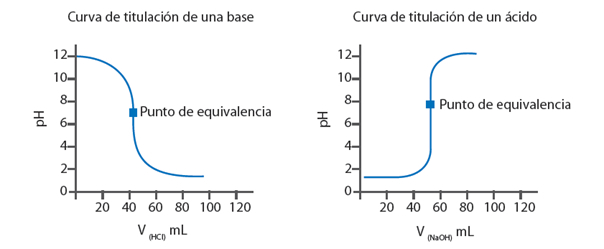

Por ejemplo, al titular 25 mL de NaOH de concentración 0,5M con HCl 0,5M del cual se disponen 10 mL, se debe conocer en primer lugar la cantidad de moles de cada sustancia, teniendo en consideración que los moles son iguales a la concentración molar por el volumen de solución.
Para determinar los moles de H+ se debe considerar que:
Moles H+ = Concentración de ácido x Volumen de ácido
Moles H+ = 0,5 mol/L x 0,01 L = 5 x 10-3 mol
Mientras que, para determinar los moles de OH-, se debe tener en cuenta que:
Moles OH- = Concentración de base x Volumen de base
Moles OH- = 0,5 mol/L x 0,025 L = 0,0125 mol
En este caso, considerando que los moles de ácido son menores que los moles de la base, se debe poner la base en la bureta y el ácido en el matraz. Por lo tanto, el pH de la muestra dependerá solo del ácido, cuando el volumen de la base sea igual a 0 mL. En este caso, el pH será igual a:
pH = -log 5 x 10-3
pH = 2,30
Al agregar base a la solución, por ejemplo 1 mL, se añade en el matraz una cantidad de moles específica que se calcula de la siguiente forma:
Si se añade 1 mL de base, los moles que se agregan a la muestra están dados por:
moles de OH- = Concentración de base x Volumen de base
moles de OH- = 0,5 mol/L x 0,001 L = 5 x 10-4 mol
Estos moles de OH- reaccionan con los moles de H+ presentes en el matraz formando agua. Por lo tanto, a los moles de ácido que inicialmente se tenían en el matraz, se le debe restar el ácido añadido, ya que estos, han neutralizado su efecto.
Moles de H+ = 5 x 10-3 mol – 5 x 10-4 mol = 4,5 x 10-3 mol
Al añadir 1 mL a la muestra, ahora la cantidad total de la muestra será 11 mL, por lo tanto, la nueva concentración de la muestra estará dado por:
Concentración de ácido = moles de H+/Volumen de la muestra
Concentración de ácido = 4,5 x 10-3 mol / 0,011 L = 0,409 mol/L
A partir de esto, es posible, conocer el pH de la muestra, luego de haber añadido la base, lo que estará dado por:
pH = -log 4,5 x 10-3
pH = 2,35
Por lo tanto, luego de añadir 1 mL de base a la muestra, la disolución aumento su pH
Más información sobre titulación acido-base.....
8. Cálculos de solubilidad y producto de solubilidad
La solubilidad indica la máxima conentración molar de iones en
equilibrio con el sólido en una disolución saturada. Para una sal es
posible determinar la constante del producto de solubilidad a partir de
la solubilidad, y también la solubilidad a partir de la constante del
producto de solubilidad. Veamos dos ejemplos:

La solubilidad del sulfato de
calcio en disolución acuosa a 25ºC es de 0.2 g de sulfato cálcico en 100
mL. ¿ Cuál es la valor de la constante del producto de solubilidad?
Solución:
Escribimos la ecuación de disociación del sulfato cálcico:
![]()
Cada
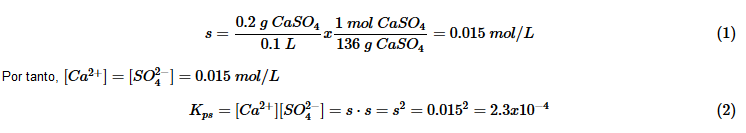
En este segundo ejemplo vamos a
calcular la solubilidad del yoduro de plomo a partir de su constante del
producto de solubilidad la

Cálculo de solubilidad y producto de solubilidad