Libro
GASES EN LA MADRE TIERRA
Requisitos de finalización
3. Aplicación de la ley de Avogadro en cálculos estequiométricos con sustancias gaseosas
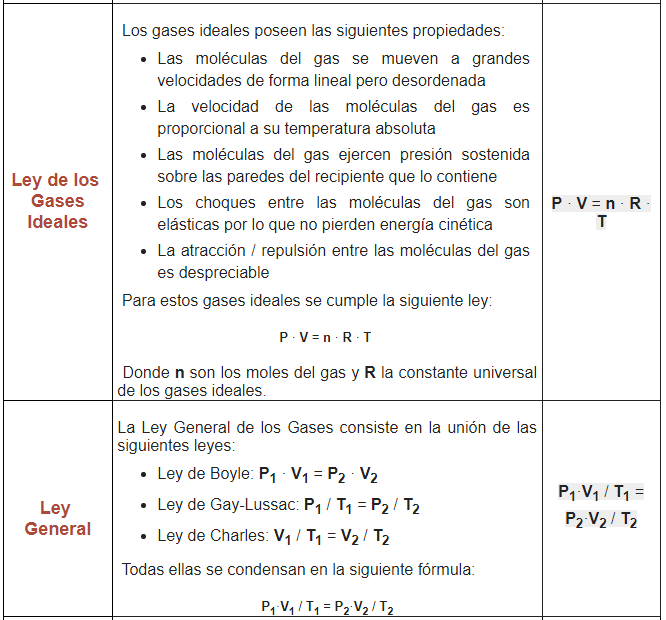
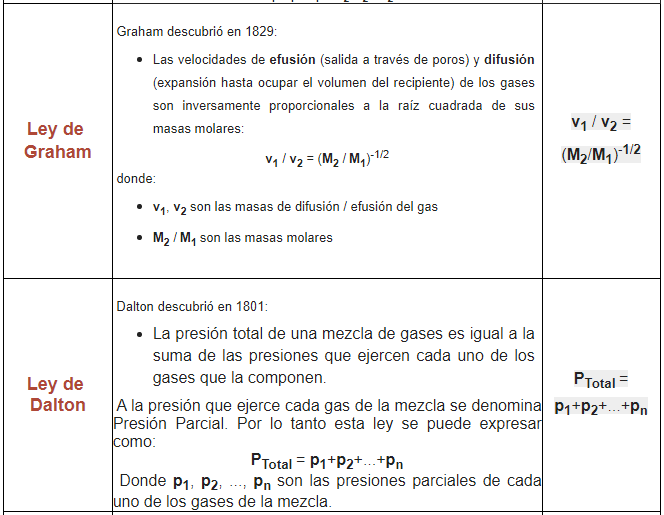
Ley de Avogadro:
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
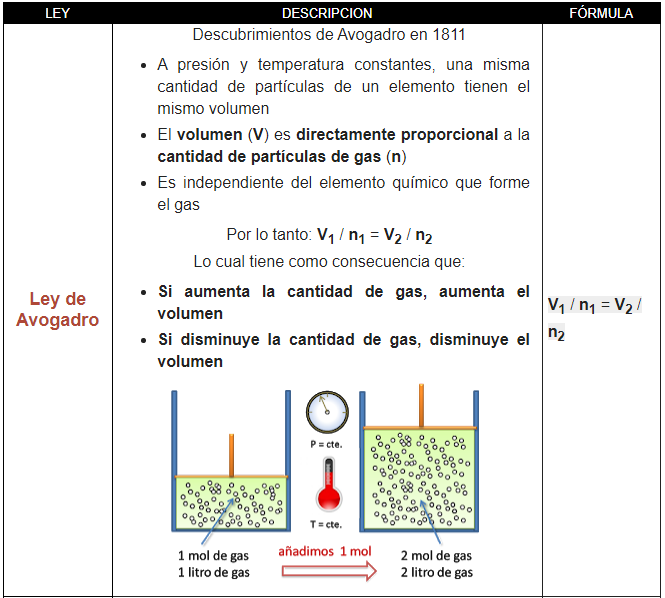
En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
Ejemplos Resueltos de la Ley de Avogadro:
Ejemplo 1: sean 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
- V1 / n1 = V2 / n2
- V1 = 2 litros
- n1 = 0,5 moles
- n2 = 0,5 + 1 = 1,5 moles
- V2 = V1 · n2 / n1 = 2 · 1,5 / 0,5 = 6 litros