GASES EN LA MADRE TIERRA
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 5° - Ciencias Naturales: Química |
| Libro: | GASES EN LA MADRE TIERRA |
| Impreso por: | Invitado |
| Fecha: | domingo, 2 de febrero de 2025, 22:18 |
Tabla de Contenidos
- 1. Propiedades de los gases e impacto en las condiciones atmosféricas en los ecosistemas
- 2. Aplicación de las leyes de los gases ideales en la vida diaria y la medicina.
- 3. Aplicación de la ley de Avogadro en cálculos estequiométricos con sustancias gaseosas
- 4. Teoría cinética de los gases y contaminación atmosférica de la Madre Tierra (SO2, CO2, CO y otros).
1. Propiedades de los gases e impacto en las condiciones atmosféricas en los ecosistemas
Propiedades de los gases
Los gases son fluidos que tienen una capacidad de compresión muy elevada, los cuales llegan a tener cambios muy grandes de densidad con la temperatura y la presión.
Las partículas que componen los gases están muy separadas entre sí, por tanto casi no existe fuerza de atracción de ello. Existen varios tipos de gases, como son los gases inflamables, corrosivos, comprimidos, licuados, oxidantes, mezcla de calibración, industrial, mezcla industrial, criogénico o gas tóxico.
¿Cuáles son las propiedades de los gases?
Carecen de forma propia
Los gases nunca presentan una forma propia, más bien tienen la capacidad de adaptarse a la forma que presente el recipiente que lo contendrá.

Propiedades de dilatación y contracción
Los gases llegan a mostrar una excelente capacidad para contraerse y dilatarse como cualquier líquido y sólido. Estos gases se dejan comprimir con una gran facilidad.
Sus moléculas hacen reducir el volumen del gas cuando se acercan una a las otras, lo cual sucede cuando se le aplica una determinada presión.
Propiedades de resistencias
Se trata de la propiedad que presentan los gases para oponerse al movimiento de los cuerpos directamente en el aire. Esta acción sucede por la fuerza roce, donde mientras más velocidad y tamaño tenga el cuerpo será mucho más grande su resistencia.
Propiedades de difusión
Esta propiedad le permite a los gases mezclarse con otros gases con una gran facilidad, esto se debe por el movimiento de sus moléculas.
Fluidez
A través de esta propiedad una gas tiene la capacidad de ocupar cualquier espacio, ya que este no tiene fuerza de unión entre las partículas que le forman.

Propiedades de compresión
Se refiere a la disminución en el volumen del gas lo cual se crea cuando las moléculas que le conforman comienzan a acercarse unas a otras cuando se le aplica cierta presión.
Propiedades químicas
Los gases son considerados como tóxicos, comburentes, corrosivos, inertes y como combustibles. Se consideran inertes porque no arden ni mantiene el estado de combustión. Son combustibles porque pueden arden fácilmente cuando detectan algún medio oxidante o el aire. Es comburente porque logra mantener la combustión.
Por otro lado se le considera como corrosivo ya que llega a afectar los tejidos de la piel o de cualquier material que estén próximo a él; y por último es tóxico porque son perjudiciales para la salud de todo ser vivo, donde al estar en concentración pura puede llegar a ser fatal.
- Dióxido de carbono (CO₂): es el de mayor preocupación, debido a la gran cantidad de emisiones de este gas producto de la actividad humana. Ha aumentado su concentración en un 40% desde el año 1750 (con 280 ppm) hasta el 2015 (con 400 ppm).
- Metano (CH₄): es producto de la descomposición. Debido a la extensión de las actividades ganaderas, este gas ha aumentado por la descomposición de las heces del ganado.
- Clorofluorocarbonos (CFC): fueron introducidos en los años 1930, se considera como el principal agente destructor de la capa de ozono. Debido a medidas políticas, ha disminuido su uso a nivel mundial.
- Óxido de nitrógeno (NOₓ): producto de la combustión a altas temperaturas, como en vehículos, otras maquinarias y la combustión de carbono, petroleo o gas natural.
Fuente: https://www.agro.uba.ar/users/semmarti/Atmosfera/contatmosf.pdf
1.1. Propiedades de los gases y su explicación
2. Aplicación de las leyes de los gases ideales en la vida diaria y la medicina.
Los gases lo podemos evidenciar en la vida cotidiana en muchos casos.
A continuación podrás ver algunos ejemplos:
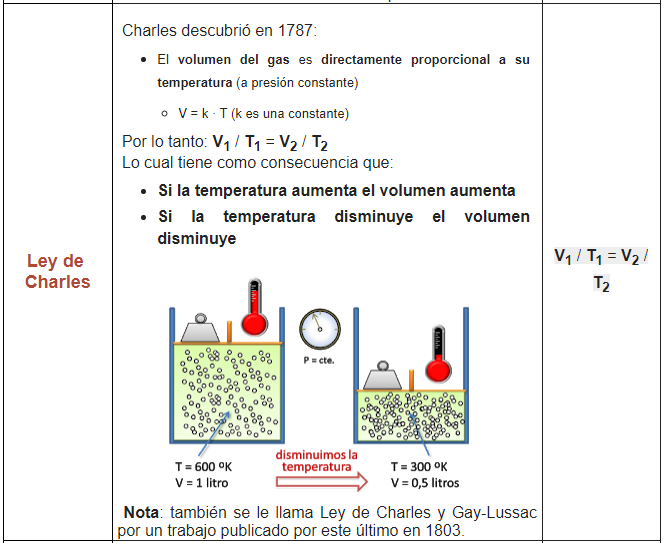
1. En un globo aerostático podemos observar la Ley de Charles, al calentar el gas el globo tiende a expandirse más, es decir, su volumen aumenta, logrando elevar el globo a mayor altura.

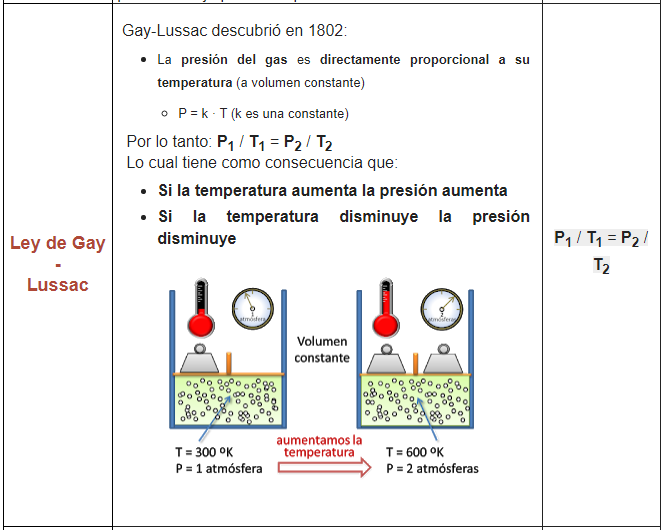
2. En la olla a presión podemos observar la Ley de Gay Lussac porque el recipiente de una olla a presión tiene un volumen definido, si se aumenta la temperatura, la presión interna del recipiente aumenta.

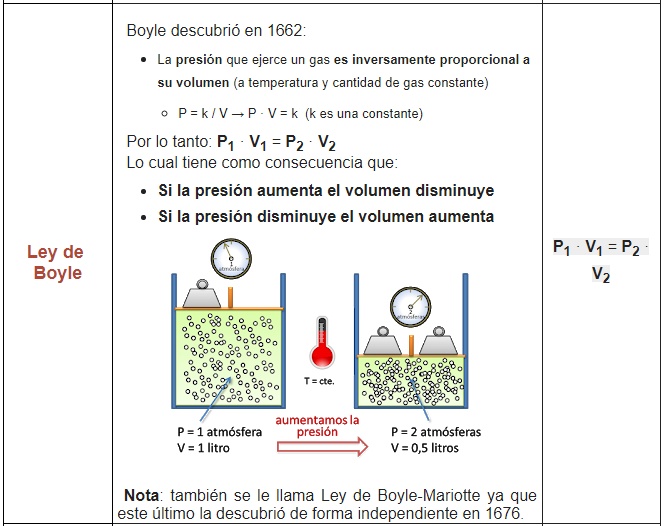
3. En un globo que inflas se puede observar la Ley de Boyle ya que a mayor presión ejercida, el volumen del globo aumenta.

4. Para la iluminación el criptón o el xenón limitan la degradación progresiva del filamento de la bombilla incandescente.


3. Aplicación de la ley de Avogadro en cálculos estequiométricos con sustancias gaseosas
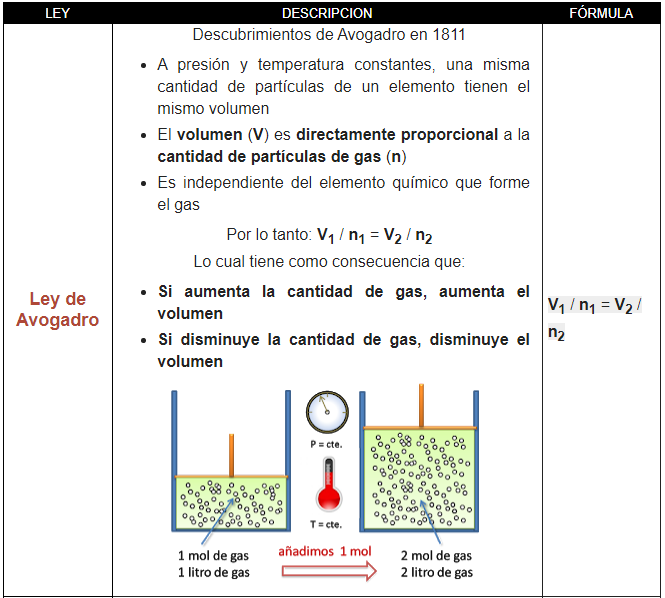
Ley de Avogadro:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
Ejemplo 1: sean 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
- V1 / n1 = V2 / n2
- V1 = 2 litros
- n1 = 0,5 moles
- n2 = 0,5 + 1 = 1,5 moles
- V2 = V1 · n2 / n1 = 2 · 1,5 / 0,5 = 6 litros
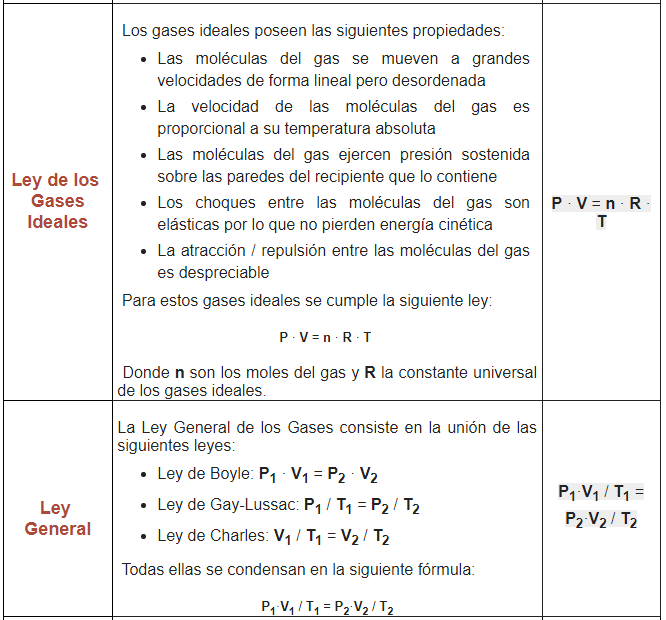
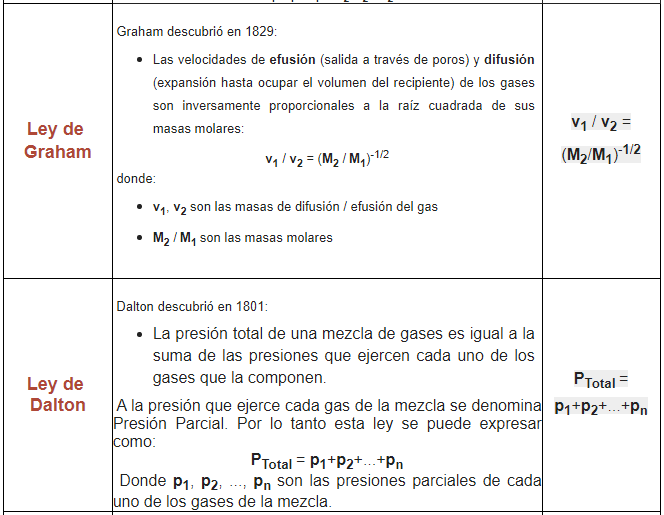

3.1. LEY DE AVOGADRO
4. Teoría cinética de los gases y contaminación atmosférica de la Madre Tierra (SO2, CO2, CO y otros).
TEORÍA CINÉTICA DE LOS GASES
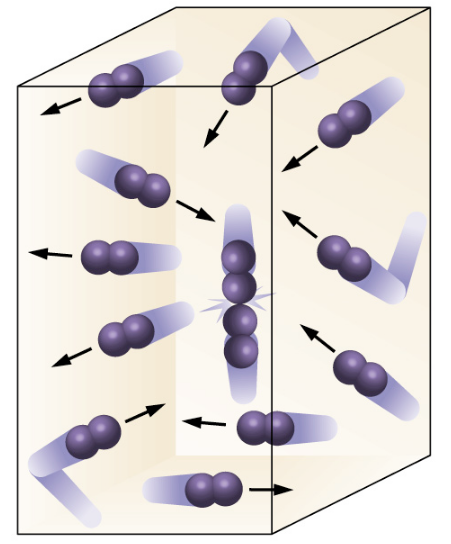
La teoría cinética de los gases explica las características y propiedades de la materia en general, y establece que el calor y el movimiento están relacionados, que las partículas de toda materia están en movimiento hasta cierto punto y que el calor es una señal de este movimiento.
La teoría cinética de los gases considera que los gases están compustos por las moléculas, partículas discretas, individuales y separadas. La distancia que existe entre estas partículas es muy grande comparada con su propio tamaño, y el volumen total ocupado por tales corpúsculos es sólo una fracción pequeña del volumen ocupado por todo el gas. por tanto, al considerar el volumen de un gas debe tenerse en cuenta en primer lugar un espacio vacío en ese volumen.
El gas deja muchos espacios vacíos y esto explica la alta comprensibilidad, la baja densidad y la gran miscibilidad de unos con otros.
Hay que tener en cuenta que:
1. No existen fuerzas de atracción entre la moléculas de un gas.
2. Las moléculas de los gases se mueven constantemente en línea recta por lo que poseen energía cinética.
3. En el movimiento, las moléculas de los gases chocan elásticamente unas con otras y con las paredes del recipiente que las contiene en una forma perfectamente aleatoria.
4. La frecuencia de las colisiones con las paredes del recipiente explica la presión que ejercen los gases.
5. La energía de tales partículas puede ser convertida en calor o en otra forma de energía. pero la energía cinética total de las moléculas permanecerá constante si el volumen y la temperatura del gas no varían; por ello, la presión de un gas es constante si la temperatura y el volumen no cambian.
Los contaminantes atmosféricos
Los contaminantes atmosféricos se clasifican en dos grandes grupos: los gases y las partículas.
Normalmente, los productos contaminantes se encuentran mezclados en el aire. Su naturaleza es muy diversa, aunque algunos destacan por su elevada proporción en el aire o por sus efectos. Por otra parte muchos reaccionan entre sí o con las otras sustancias presentes en la atmósfera, como el vapor de agua, y originan nuevos contaminantes. Así diferenciamos los contaminantes primarios, emitidos directamente por una fuente, de los secundarios, producto de reacciones ulteriores. El tiempo que un contaminante permanece en el aire se conoce con el nombre de tiempo de residencia. Este tiempo es más o menos largo según el tipo de contaminante y el estado de la atmósfera. Para los gases, el tiempo de residencia depende de su capacidad de reacción, los más reactivos permanecen menos tiempo en el aire. Para las partículas depende de su medida.
Las unidades con las que se miden las partículas son microgramos de contaminante por metro cúbico. En el caso de los gases, las unidades son las partes por millón. Dentro de los compuestos de azufre, los óxidos se originan en las combustiones de combustible fósiles que contienen azufre, como es el caso del carbón, el petróleo y algunos derivados. Las principales fuentes son las centrales térmicas, diversos procesos industriales, el tránsito automovilístico y ciertas calefacciones.

Los óxidos de azufre más importantes por lo que respecta a la contaminación atmosférica son el dióxido de azufre, SO2y el trióxido de azufre, SO3. La emisión del trióxido es muy superior cuantitativamente a la del trióxido. Los dos se emiten conjuntamente y la proporción del segundo es de un 1% a un 5% del total. El dióxido de azufre en altas concentraciones puede ser un gas irritante que provoca alteraciones en los ojos y en las vías respiratorias. En determinadas circunstancias, se producen reacciones químicas en las cuales este dióxido se puede transformar en trióxido. Por su parte, el trióxido de azufre no permanece mucho tiempo en la atmósfera, ya que es altamente higroscópico y en contacto con la humanidad se transforma en ácido sulfúrico. Este ácido arrastrado por el agua de lluvia tiene efectos corrosivos producidos por la lluvia ácida sobre los recursos naturales.
El sulfuro de hidrógeno, SH2a altas concentraciones, es un gas tóxico que produce un olor desagradable y característico. Se produce de forma natural por putrefacción de la materia orgánica, en el fondo de los lagos y las balsas que se encuentran en condiciones anaeróbicas, en ausencia de oxígeno. En cuanto a en la liberación antropogénica del sulfuro de hidrógeno, es clásico de las industrias papeleras y también de las refinerías.
En la atmósfera, el sulfuro de hidrógeno se transforma con cierta facilidad en dióxido de azufre, el cual aumenta la concentración en la atmósfera.

En una primera reacción, los óxidos de nitrógeno se transforman, en la atmósfera en ácido nítrico o nitratos. Este ácido, muy corrosivo, es arrastrado por el agua de lluvia y llega a ser uno de los constituyentes de las lluvias ácidas. Los óxidos de nitrógeno intervienen también en la destrucción de la capa de ozono. Aunque actúen sólo como catalizadores, pequeñas cantidades de óxido pueden destruir grandes cantidades de ozono hasta que no son eliminados de la estratosfera por un lento proceso natural. En el caso de la aviación, los reactores inyectan los óxidos de nitrógeno directamente a la estratosfera y agravan de esta manera el efecto.
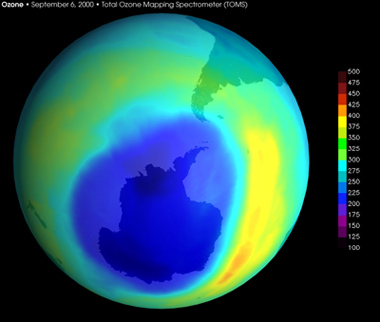
Los óxidos de carbono son otra familia de contaminantes. Los principales son el monóxido de carbono, CO, y el dióxido de carbono, CO2. El monóxido de carbono se produce por la combustión incompleta de combustibles orgánicos, es decir, en una situación de falta de oxígeno que imposibilita la oxidación completa a CO2. Los máximos productores son los automóviles y los procesos en los que intervienen las combustiones. El monóxido de carbono es una sustancia altamente tóxica porque se combina con la hemoglobina de la sangre e impide el transporte de oxígeno a los tejidos, y por tanto la respiración. El dióxido de carbono es un gas que se encuentra normalmente en la atmósfera en una concentración media del 0,03%. Se produce de forma natural en la respiración de los seres vivos y en las combustiones. Se consume por la fotosíntesis de las plantas. Además el dióxido de carbono tiene una participación determinante en el calentamiento del planeta, ya que absorbe la radiación infrarroja proveniente del sol y de los océanos. Este fenómeno se conoce con el nombre de efecto invernadero.
Los hidrocarburos a elevadas concentraciones tienen efectos irritantes. La fuente más grande de producción de hidrocarburos es la natural. El metano es el contaminante que representa la mayor parte de esta producción. La actividad humana, especialmente el tránsito de vehículos, algunos procesos de combustión de materia orgánica y también las refinerías de petróleo y los procesos que trabajan con disolventes producen una importante cantidad de hidrocarburos de diversos tipos. Los hidrocarburos pueden reaccionar con los óxidos de nitrógeno, bajo condiciones de fuerte radiación solar y producir la aparición del fenómeno de la niebla fotoquímica.
Los oxidantes a elevadas concentraciones son fuertemente irritantes y lacrimógenos, perjudican la vegetación y tienen la propiedad de agrietar el caucho en tensión, por ejemplo, los neumáticos de los automóviles. Los oxidantes son el producto de las reacciones fotoquímicas entre los óxidos de nitrógeno y los hidrocarburos y son considerados contaminantes secundarios, aquellos que no son directamente emitidos por una fuente emisora sino que se forman en el propio aire. El principal oxidante es el ozono, pero hay otros, derivados de los hidrocarburos, como los nitroperóxidos de acilo conocidas por las siglas inglesas PAN. Aparecen en forma de niebla fotoquímica. Son clásicos de las zonas urbanas y los automóviles tienen un importante papel en su aparición.
Los compuestos halogenados con mayor incidencia sobre la calidad del aire son los compuestos de flúor , los de cloro y los freones, compuestos de cloro y flúor. Los compuestos de flúor son emitidos principalmente por las industrias de la cerámica, de aluminio y de vidrio. Ya que el flúor tiene un cierto papel en algunos procesos fisiológicos de los organismos, un aumento importante de su concentración puede tener consecuencias negativas, especialmente en los niños. Además al reaccionar con el vapor de agua, se forma el ácido fluorhídrico, que es muy corrosivo. Los compuestos de cloro son emitidos principalmente por la industria petroquímica, los procesos de combustión de materiales plásticos u otros que contengan cloro. Los freones son gases que se utilizan como propulsores de los aerosoles y en sistemas de refrigeración. Estos compuestos tienen efectos negativos sobre la capa de ozono y es por ello que se está limitando su uso.
Entre los metales emitidos a la atmósfera con mayor incidencia tenemos: el plomo, el cadmio, el níquel, el hierro, el mercurio, el cromo, el cobre, el manganesio y el arsénico. El más importante y el que más abunda en la atmósfera es el plomo. Proviene principalmente de lo que se incluye en la gasolina de los automóviles como antidetonante. Este fenómeno de contaminación se está reduciendo notablemente con el uso de vehículos que utilizan gasolina sin plomo. Todos estos metales tienen características tóxicas y se acumulan en los tejidos de los organismos, donde pueden alcanzar concentraciones notables.
4.1. CONTAMINACIÓN ATMOSFÉRICA - Contaminación ambiental
