ENERGÍA Y MATERIA COMO FUNDAMENTO DE LA VIDA EN LA MADRE TIERRA
4. Estructura de la materia, cambios de estado y sus trasformaciones
Estructura de la materia
La materia consiste de partículas extremadamente pequeñas agrupadas juntas para formar el átomo. Hay una 90 ocurrencias naturales de estas agrupaciones de partículas llamadas elementos.
Estos elementos fueron agrupados en la tabla periódica de los elementos en secuencia de acuerdo a sus números atómicos y peso atómico. Hay además 23 elementos hechos por el hombre que no ocurren en la naturaleza, por lo que al final son unos 113 elementos conocidos hasta la fecha. Estos elementos no pueden cambiarse por procesos químicos. Ellos solo pueden ser cambiados por reacción nuclear o atómica, sin embargo pueden ser combinados para producir el incontable número de compuestos con los que tropezamos día a día.
La composición del elemento que se conoce mundialmente como materia es muy compleja ya que todavía no se conoce con exactitud de donde se origino la materia que conocemos hoy en día.
Como ya se dijo con anterioridad parte de los componentes por los cuales esta conformada la estructura de la materia es la energía debido a que es la causante de que todas las cosas se ven afectadas por las leyes del espacio y del tiempo.
Asimismo otro de los componentes por los cuales está conformada la materia son una gran cantidad de partículas de distintos tipos muy pequeñas que se agrupan en grandes cantidades para poder completar la estructura de lo que se conoce como materia.
Todas estas agrupaciones de partículas de pequeño tamaño forman a lo que se conocen como átomos los cuales a su vez dan forma a lo que se conoce hoy en día como las células que pueden ser tanto vegetales como animales.
Además estas agrupaciones de partículas también son las causantes de generar los famosos elementos naturales los cuales se encuentran ubicados en lo que se conoce como la famosa tabla periódica.
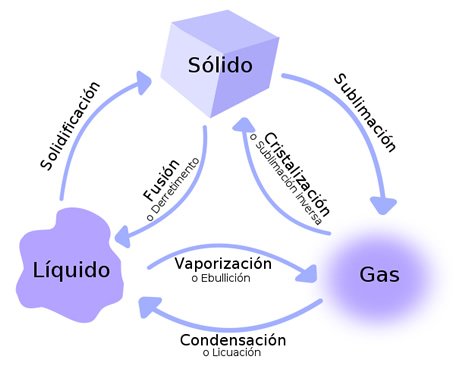
Estados de la materia y sus transformaciones
1- Estados y cambios de estado de la materia
Recuerda que:
En toda molécula existen 2 tipos de fuerzas intermoleculares.
- Fuerza de atracción (Fa): Que nos permite la cohesión y el ordenamiento de las moléculas.
- Fuerza de repulsión (Fr): Que permite la separación de las moléculas.
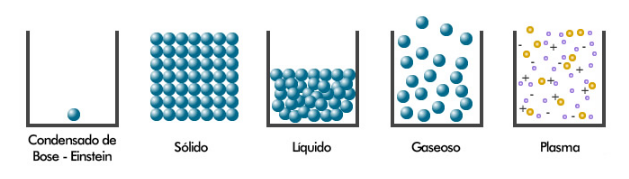
Se caracteriza por tener forma y volumen definido, debido a que la fuerza de atracción intermolecular es mayor que la fuerza de repulsión.
b) Estado líquido
Se caracteriza por tener volumen definido y forma variable según el recipiente que lo contenga, debido al equilibrio existente entre la fuerza de atracción y la de repulsión.
c) Estado gaseoso
Estos carecen de forma y volumen definido, ya que la fuerza de repulsión intermolecular es mayor que la fuerza de atracción.
d) Estado Plasmático
Es el cuarto estado de la materia, es energético y se considera al plasma, como un gas cargado eléctricamente (ionizado); conformado por moléculas, átomos, electrones y núcleos; estos últimos provenientes de átomos desintegrados. Se encuentra a elevadísimas temperaturas de 20000º C. Ejemplo, el núcleo del sol, de las estrellas, energía atómica.En la superficie terrestre a una distancia de 200 Km, se encuentra el plasma de hidrógeno conformando el cinturón de Van Allen.
Representan un quinto estado de la materia visto por primera vez en 1955. El estado lleva el nombre de Satyendra Nath Bose y Albert Einstein, quien predijo su existencia hacia 1920. Los condensados B-E son superfluídos gaseosos enfriados a temperaturas muy cercanas al cero absoluto (-273 ° C o −459,67 °F).
La materia cambia de un estado a otro por efecto de la temperatura y presión, ya sea aumentando o disminuyendo la energía calórica. En la naturaleza es frecuente observar que la materia cambia de un estado a otro. Tal vez el ejemplo más conocido sea el caso del agua, que se puede encontrar en forma sólida, líquida y gaseosa.
Se reconocen 2 tipos de cambios de estado: Progresivos y regresivos.
Los cambios de estado progresivos se producen cuando se aplica calor a los cuerpos y son: sublimación progresiva, fusión y evaporación.
Sin embargo, si se aplica mayor calor, tanto las partículas de la superficie como las del interior del líquido podrán pasar al estado gaseoso. El cambio de estado así producido se llama Ebullición. La temperatura que cada sustancia necesita para alcanzar la ebullición es característica de cada sustancia y se denomina Punto de Ebullición. Por ejemplo, el punto de ebullición del H2O a nivel del mar es 100º C.
Los cambios de estado regresivos son aquellos que se producen cuando los cuerpos se enfrían. Se reconocen 3 tipos: Sublimación regresiva, solidificación y condensación.