ENERGÍA Y MATERIA COMO FUNDAMENTO DE LA VIDA EN LA MADRE TIERRA
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 1° - Ciencias Naturales |
| Libro: | ENERGÍA Y MATERIA COMO FUNDAMENTO DE LA VIDA EN LA MADRE TIERRA |
| Impreso por: | Invitado |
| Fecha: | lunes, 7 de abril de 2025, 06:31 |
1. La materia y sus propiedades. Aplicación de la densidad
LA MATERIA Y SUS PROPIEDADESMATERIA: Es Todo aquello que tiene masa y ocupa un lugar en el Espacio.
- Si tiene masa y ocupa un lugar en el Espacio Que significa es cuantificable, es Decir, Que Se Puede Medir.
- •Todo cuanto podemos imaginar, desde un libro, un auto, el computador y hasta la silla en que nos sentamos y el agua que bebemos, o incluso algo intangible como el aire que respiramos, está hecho de materia.
•Los planetas del Universo, los seres vivos como los insectos y los objetos inanimados como las rocas, están también hechos de materia.
Las propiedades de la materia se clasifican en dos grandes grupos: generales o extrínsecas y especificas o intrínsecas.
I. Propiedades Generales:Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
- Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
- Volumen: Un cuerpo ocupa un lugar en el espacio
- Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
- Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
- La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
- La impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente.
- Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana.
2. Propiedades especificas: Son aquellos que no dependen de la cantidad de materia, los más importantes son:
La densidad se calcula a través de una fórmula matemática que muestra la relación que existe entre esas dos magnitudes.
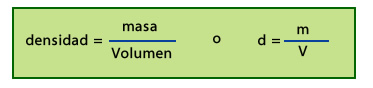
Las unidades de medida de la densidad son el kg/m3, que se lee “kilogramo sobre metro cúbico” o un sub-múltiplo como g/cm3.
Las sustancias con grandes densidades se les llama pesadas, ejemplo de estas son los metales. A las sustancias con densidades pequeñas se les llama ligeras, aquí entran el aire y otros gases.
La densidad de un cuerpo está relacionada con su capacidad de flotar. Un cuerpo flotará si su densidad es menor que la de la sustancia, por eso la madera flota sobre el agua y el plomo se hunde en ella. El plomo posee mayor densidad que el agua y la densidad de la madera es menor, pero ambas sustancias se hundirán en la gasolina, de densidad más baja .
Más información https://ue.aprendiendomas.com.bo/pluginfile.php/144/mod_book/chapter/739/La%20Materia%20y%20sus%20propiedades.pdf
1.1. ¿Cuáles son las propiedades generales y específicas de la materia?
1.2. La Materia y sus propiedades
2. Equivalencia entre materia y energía
Equivalencia de materia y energía
Este artículo fue recibido por la revista alemana de física el 27 de septiembre de 1905 y fue publicado el siguiente 21 de noviembre como ¿La inercia de un cuerpo depende de su contenido de energía?. Este fue una adición al previo y establece, precisamente, que “la masa de un cuerpo es una medida de su contenido de energía”.

El artículo se refiere a una de las consecuencias de la Teoría de la Relatividad Especial relacionada con la equivalencia de materia y energía. Esta equivalencia se debe a que masa y energía son cantidades proporcionales. Es decir, una pequeña masa implica una gran energía porque la proporcionalidad es la velocidad de la luz y, ésta es grande. Esto se expresa en la más famosa de las ecuaciones de la física de todos los tiempos: E=mc2, donde m representa a la masa, E es la energía y c es la velocidad de la luz igual a 300 mil km/s.
En síntesis, de acuerdo al propio Einstein, “... la masa es una medida directa de la energía contenida en los cuerpos...”. Por otra parte, de acuerdo al Principio de Relatividad “... la luz transfiere masa...”.
Los novedosos conceptos, han sido probados y comprobados varias veces hasta el día de hoy, sin embargo, le parecían chistosos a Einstein. “Esta idea es divertida y contagiosa pero posiblemente no puedo saber si el buen Dios no se ríe de ella y está tratando de embaucarme...”, escribió. Pero no, se trata de verdades con grandes consecuencias no solamente para el conocimiento sino para la vida del mundo. Hoy en día, muchas tecnologías modernas, como los microchips, se basan en la teoría de la relatividad especial.
2.1. E=mc2
3. Clasificación de la materia
CLASIFICACIÓN DE LA MATERIA
1.- Clasificación de la materia
La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas.
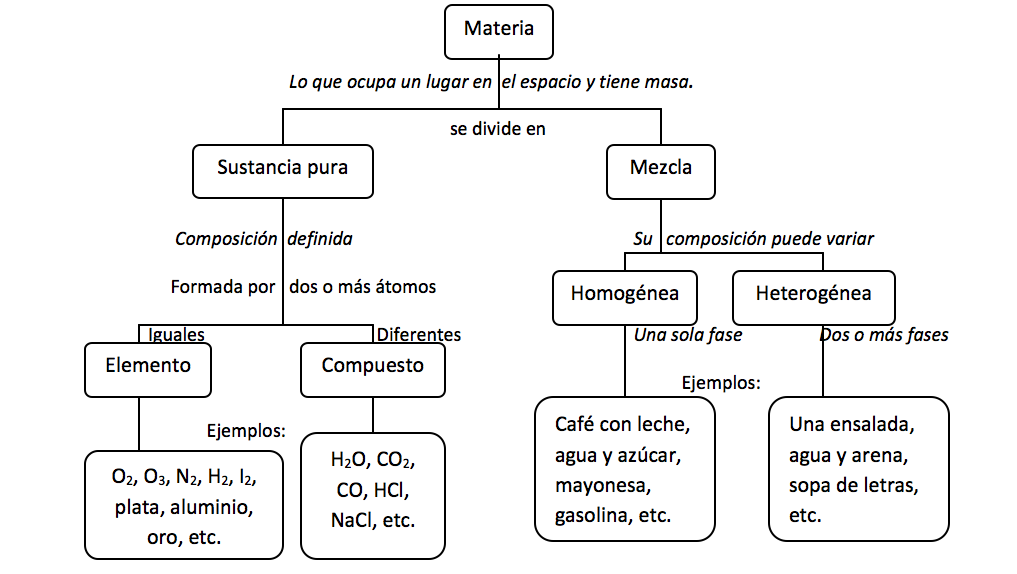
* Las sustancias puras son aquéllas cuya naturaleza y composición no varían sea cual sea su estado. Se dividen en dos grandes grupos: Elementos y Compuestos.
- Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su símbolo químico y se conocen 115 en la actualidad.
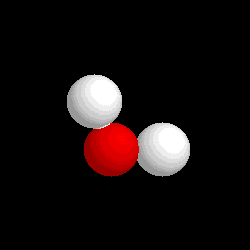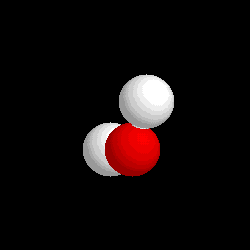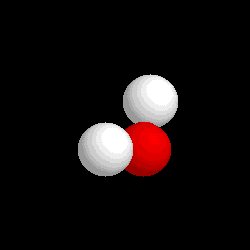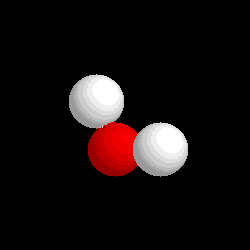
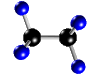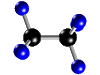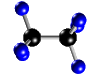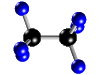
- Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula. Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
| Molécula de agua (H2O), formada por 2 átomos de hidrógeno (blancos) y 1 átomo de oxígeno (rojo) |
| Molécula de etano (C2H6), formada por 2 átomos de carbono (negros) y 6 átomos de hidrógeno (azul) |
| Molécula de butano (C4H10), formada por 4 átomos de carbono (negros) y 10 átomos de hidrógeno (blancos) |
* Las mezclas se encuentran formadas por 2 ó más sustancias puras. Su composición es variable. Se distinguen dos grandes grupos: Mezclas homogéneas y Mezclas heterogéneas.
- Mezclas homogéneas: También llamadas Disoluciones. Son mezclas en las que no se pueden distinguir sus componentes a simple vista. Ejemplo: Disolución de sal en agua, el aire, una aleación de oro y cobre, etc.

|  |
|
3.1. Clasificación de la Materia
3.2. Clasificación de la materia: sustancias, mezclas homogéneas y heterogéneas
4. Estructura de la materia, cambios de estado y sus trasformaciones
Estructura de la materia
La materia consiste de partículas extremadamente pequeñas agrupadas juntas para formar el átomo. Hay una 90 ocurrencias naturales de estas agrupaciones de partículas llamadas elementos.
Estos elementos fueron agrupados en la tabla periódica de los elementos en secuencia de acuerdo a sus números atómicos y peso atómico. Hay además 23 elementos hechos por el hombre que no ocurren en la naturaleza, por lo que al final son unos 113 elementos conocidos hasta la fecha. Estos elementos no pueden cambiarse por procesos químicos. Ellos solo pueden ser cambiados por reacción nuclear o atómica, sin embargo pueden ser combinados para producir el incontable número de compuestos con los que tropezamos día a día.
La composición del elemento que se conoce mundialmente como materia es muy compleja ya que todavía no se conoce con exactitud de donde se origino la materia que conocemos hoy en día.
Como ya se dijo con anterioridad parte de los componentes por los cuales esta conformada la estructura de la materia es la energía debido a que es la causante de que todas las cosas se ven afectadas por las leyes del espacio y del tiempo.
Asimismo otro de los componentes por los cuales está conformada la materia son una gran cantidad de partículas de distintos tipos muy pequeñas que se agrupan en grandes cantidades para poder completar la estructura de lo que se conoce como materia.
Todas estas agrupaciones de partículas de pequeño tamaño forman a lo que se conocen como átomos los cuales a su vez dan forma a lo que se conoce hoy en día como las células que pueden ser tanto vegetales como animales.
Además estas agrupaciones de partículas también son las causantes de generar los famosos elementos naturales los cuales se encuentran ubicados en lo que se conoce como la famosa tabla periódica.
Estados de la materia y sus transformaciones
1- Estados y cambios de estado de la materia
Recuerda que:
En toda molécula existen 2 tipos de fuerzas intermoleculares.
- Fuerza de atracción (Fa): Que nos permite la cohesión y el ordenamiento de las moléculas.
- Fuerza de repulsión (Fr): Que permite la separación de las moléculas.
Se caracteriza por tener forma y volumen definido, debido a que la fuerza de atracción intermolecular es mayor que la fuerza de repulsión.
b) Estado líquido
Se caracteriza por tener volumen definido y forma variable según el recipiente que lo contenga, debido al equilibrio existente entre la fuerza de atracción y la de repulsión.
c) Estado gaseoso
Estos carecen de forma y volumen definido, ya que la fuerza de repulsión intermolecular es mayor que la fuerza de atracción.
d) Estado Plasmático
Es el cuarto estado de la materia, es energético y se considera al plasma, como un gas cargado eléctricamente (ionizado); conformado por moléculas, átomos, electrones y núcleos; estos últimos provenientes de átomos desintegrados. Se encuentra a elevadísimas temperaturas de 20000º C. Ejemplo, el núcleo del sol, de las estrellas, energía atómica.En la superficie terrestre a una distancia de 200 Km, se encuentra el plasma de hidrógeno conformando el cinturón de Van Allen.
Representan un quinto estado de la materia visto por primera vez en 1955. El estado lleva el nombre de Satyendra Nath Bose y Albert Einstein, quien predijo su existencia hacia 1920. Los condensados B-E son superfluídos gaseosos enfriados a temperaturas muy cercanas al cero absoluto (-273 ° C o −459,67 °F).
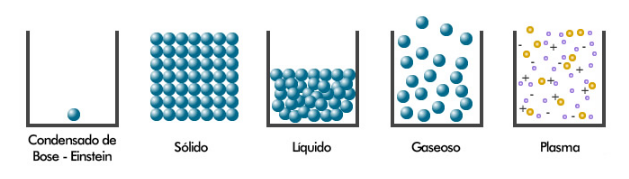
La materia cambia de un estado a otro por efecto de la temperatura y presión, ya sea aumentando o disminuyendo la energía calórica. En la naturaleza es frecuente observar que la materia cambia de un estado a otro. Tal vez el ejemplo más conocido sea el caso del agua, que se puede encontrar en forma sólida, líquida y gaseosa.
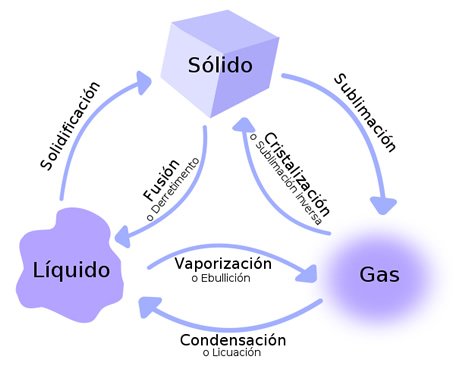
Se reconocen 2 tipos de cambios de estado: Progresivos y regresivos.
Los cambios de estado progresivos se producen cuando se aplica calor a los cuerpos y son: sublimación progresiva, fusión y evaporación.
Sin embargo, si se aplica mayor calor, tanto las partículas de la superficie como las del interior del líquido podrán pasar al estado gaseoso. El cambio de estado así producido se llama Ebullición. La temperatura que cada sustancia necesita para alcanzar la ebullición es característica de cada sustancia y se denomina Punto de Ebullición. Por ejemplo, el punto de ebullición del H2O a nivel del mar es 100º C.
Los cambios de estado regresivos son aquellos que se producen cuando los cuerpos se enfrían. Se reconocen 3 tipos: Sublimación regresiva, solidificación y condensación.
4.1. Los estados de la materia y sus cambios. Sólido, líquido y gaseoso