Libro
LA TERMOQUÍMICA EN PROCESOS ENERGÉTICOS SUSTENTABLES Y LA ELECTROQUÍMICA EN LA PRODUCCIÓN TECNOLÓGICA SOCIOCOMUNITARIA
Requisitos de finalización
2. Entalpías de reacciones químicas y ley de Hess
Los enlaces químicos representan energía potencial. Cuantificar la energía que representan los enlaces de diferentes moléculas es una parte importante de la comprensión de la energía total implicada en una reacción. En el presente artículo vamos a explorar dos conceptos diferentes que ayudan a describir esa energía: la entalpía de reacción y la entalpía de enlace.
Entalpía de reacción
En las reacciones químicas, los enlaces entre átomos pueden romperse, reconstituirse o experimentar ambos procesos, ya sea para absorber o liberar energía. El resultado es un cambio de la energía potencial del sistema. El calor que absorbe o libera un sistema sometido a presión constante se conoce como entalpía, y el cambio de entalpía que se produce en una reacción química es la entalpía de reacción. La entalpía de reacción se escribe a menudo como 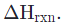
Para entender mejor la entalpía de reacción, vamos a considerar la hidrogenación del propeno, C3 H6 para formar propano, C3 H8 En esta reacción, el gas propeno reacciona con el gas hidrógeno,H2 (g) , para formar gas propano de la forma:

¿Qué está sucediendo en esta reacción? Primero tenemos que romper el enlace C=C del carbono y el enlace H-H de los reactivos. Como regla general, romper enlaces entre átomos requiere agregar energía. Cuanto más fuerte sea el enlace, más energía se necesita para romperlo. Para formar el producto propano, se forma un nuevo enlace C=C y dos nuevos enlaces de C-H. Ya que romper enlaces requiere agregar energía, el proceso opuesto de formar nuevos enlaces siempre libera energía. Cuanto más fuerte es el enlace formado, se libera más energía durante el proceso de su formación. En esta reacción particular, a causa de que los enlaces recientemente formados liberan más energía de la que se necesita para romper los enlaces originales, el sistema resultante tiene una energía potencial menor que la de los reactivos· Esto significa que la entalpía de reaccción es negativa.
Matemáticamente, podemos pensar en la entalpía de reacción como la diferencia entre la energía potencial de los enlaces del producto y la energía potencial de los enlaces de los reactivos:
=energıˊa agregada para romper los enlaces de los reactivos+energıˊa liberada al formarse los enlaces del producto
Las reacciones en las que los productos tienen una energía potencial más baja que la de los reactivos, tales como la hidrogenación de propeno descrita arriba, son exotérmicas. Las reacciones en las que los productos tienen más energía potencial que la de los reactivos son endotérmicas.
En una reacción exotérmica, la energía liberada no desaparece simplemente. Más bien, se convierte en energía cinética, que produce calor. Esto se observa como un aumento de temperatura a medida que avanza la reacción. Por otra parte, las reacciones endotérmicas suelen requerir que se agregue energía para favorecer la formación de productos. En la práctica, esto generalmente significa manejar una reacción a una temperatura más alta con una fuente de calor.
Para cuantificar la entalpía de reacción para un caso dado, un enfoque posible es utilizar las entalpías de formación estándar para todas las moléculas involucradas. Estos valores describen el cambio en la entalpía para formar un compuesto desde sus elementos constitutivos. La entalpía de reacción para el sistema se aproxima como la diferencia de las entalpías de formación estándar de los reactivos y las de los productos. Para aprender más sobre entalpías de formación (que también se llaman calores de formación) y cómo utilizarlas para calcular la entalpía de reacción, puedes revisar nuestro video sobre calor de formación estándar y el video sobre el uso de calores de formación para calcular las entalpías de reacción.
Un enfoque alternativo es estimar la entalpía de reacción tomando en cuenta los enlaces individuales afectados en la reacción. Si sabemos cuánta energía necesitamos para formar y romper cada uno de los enlaces, podemos entonces sumar esos valores para encontrar la entalpía de reacción. Discutiremos este método con más detalle en el resto del presente artículo.
Entalpía de enlace
La entalpía de enlace (también conocida como entalpía de disociación de enlace, energía de enlace promedio o fuerza de enlace) describe la energía almacenada en un enlace entre átomos de una molécula. Específicamente, es la energía que debe agregarse para conseguir la escisión del enlace homolítica o simétrica en fase gaseosa. Un evento homolítico o evento de ruptura de enlace simétrica significa que cuando el enlace se ha roto, cada uno de los átomos que eran parte el enlace original recibe un electrón, convirtiéndose en un radical, en vez de que se forme un ion.
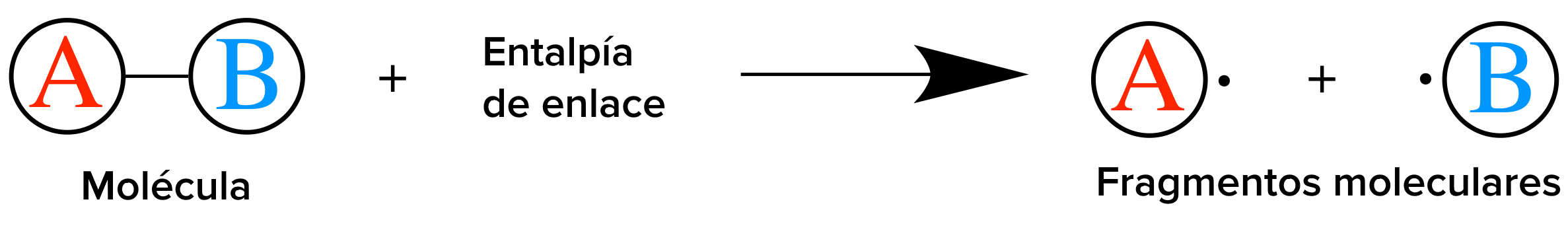
Los enlaces químicos se forman porque son termodinámicamente favorables, y para romperlos es inevitable agregar energía. Por esta razón, los valores de entalpía de enlace siempre son positivos, y suelen tener unidades de Kj / mol o kcal / mol. Cuanto mayor sea la entalpía de enlace, éste es más fuerte y más energía se necesita para romperlo. Para determinar cuánta energía se liberará cuando, en lugar de romperse, se forme un nuevo enlace, simplemente hacemos negativo el valor de la entalpía de enlace.
Puesto que los valores de entalpía de enlace son tan útiles, las entalpías de enlace promedio para tipos de enlace comunes están disponibles en tablas de referencia. En tanto que el cambio exacto de energía que se produce cuando se forman y rompen enlaces depende de los átomos vecinos en una molécula específica, los valores promedio listados en las tablas pueden utilizarse a manera de aproximación.
Sugerencia: los valores para los enlaces listados en las tablas corresponden a un mol de reacción para un solo enlace. Esto significa que si hay varios enlaces del mismo tipo en cierta reacción, en proceso de ruptura o de formación, en tus cálculos, debes multiplicar la entalpía de enlace por el número de enlaces de ese tipo que hay en la reacción. Esto también significa que es importante asegurarte que la ecuación esté balanceada y que los coeficientes se escriban como los enteros más pequeños posibles, de modo que se use el número correcto de enlaces.
El uso de las entalpías de enlace para calcular la entalpía de reacción
Una vez que entendemos lo que es la entalpía de enlace, la usamos para estimar la entalpía de reacción. Para ello, podemos seguir este procedimiento:
Paso 1. En los reactivos identifica cuáles enlaces se romperán y sus entalpías de enlace.
Paso 2. Suma los valores de entalpía de enlace para los enlaces rotos.
Paso 3. identifica qué nuevos enlaces se forman en los productos y haz una lista de sus entalpías de enlace negativas. Recuerda que tenemos que cambiar el signo de los valores de entalpia para encontrar la energía liberada cuando se forman los enlaces.
Paso 4. Suma los valores de entalpía de enlace para los enlaces formados del producto.
Paso 5. Combina los valores totales para los enlaces rotos (del Paso 2) y enlaces de formación (del Paso 4) para obtener la entalpía de reacción.
Ejemplo: hidrogenación del propeno
Encontremos la entalpía de reacción de la hidrogenación del propeno, nuestro ejemplo del principio del artículo.
Paso 1: identifica los enlaces rotos
En esta reacción se rompe un enlace C=C y un H-H
Usando una tabla de referencia, encontramos que la entalpía del enlace C=C es de 610 kj/ mol y la entalpía del enlace H-H es 436 Kj/ mol
Paso 2: encuentra la energía total necesaria para romper los enlaces
Combinando los valores del Paso 1 obtenemos:
Energıˊa agregada para romper enlaces = 610 kj/ mol + 436 kj/ mol
como la energía total requerida para romper los enlaces necesarios en los gases propeno e hidrógeno.
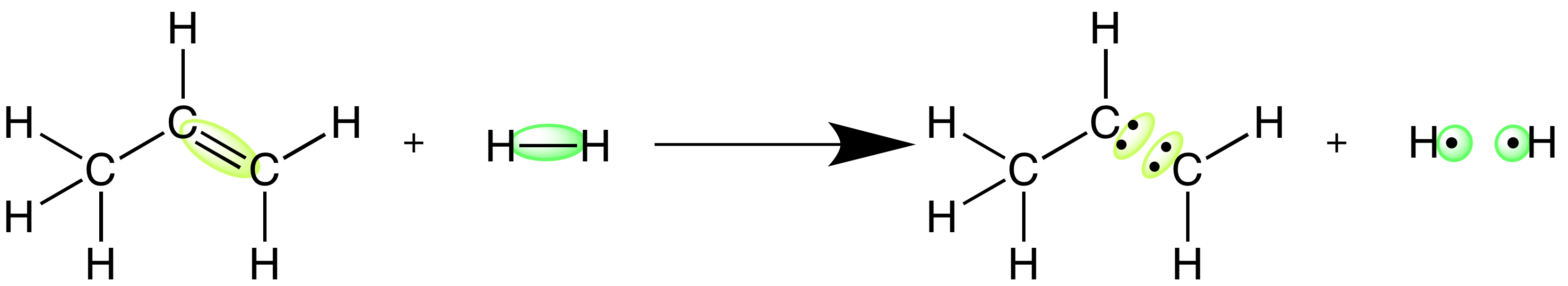
Paso 3: identifica los enlaces formados
En esta reacción se forman un enlace C-C y dos enlaces C-H nuevos.
Usando una tabla de referencia (y al tener en cuenta que estamos formando enlaces en lugar de romperlos), nos encontramos con que la entalpía del enlace C-C es de 346 kj/mol, y la entalpía para cada uno de los enlaces C-H es de 413 kj/mol para encontrar la energía liberada al formar estos enlaces, multiplicaremos las entalpías de enlace por -1 También, puesto que hay dos enlaces C-H , tendremos que multiplicar este valor por 2.
Paso 4: encontrar la energía total liberada para formar nuevos enlaces
Combinando los valores del Paso 1 obtenemos:
energía liberada para formar los enlaces de los productos= -346 kj/mol +(2* -413 kj/mol)= -1172 kj/mol
para la energía total que se libera en la formación de los enlaces nuevos.
Paso 5: suma la energía de enlaces rotos y formados
Del Paso 2 y del Paso 4, tenemos 1046, space, k, J de energía requerida para romper enlaces y -1172 kj de energía liberada al formar enlaces. De la suma de estos valores obtenemos, para la entalpía de reacción:
=1046kJ/mol+(−1172kJ/mol)
=−126kJ/mol
Puesto que la entalpía de reacción de la hidrogenación del propeno es negativa, sabemos que la reacción es exotérmica.