LA TERMOQUÍMICA EN PROCESOS ENERGÉTICOS SUSTENTABLES Y LA ELECTROQUÍMICA EN LA PRODUCCIÓN TECNOLÓGICA SOCIOCOMUNITARIA
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 6° - Ciencias Naturales: Química |
| Libro: | LA TERMOQUÍMICA EN PROCESOS ENERGÉTICOS SUSTENTABLES Y LA ELECTROQUÍMICA EN LA PRODUCCIÓN TECNOLÓGICA SOCIOCOMUNITARIA |
| Impreso por: | Invitado |
| Fecha: | viernes, 4 de abril de 2025, 12:39 |
Tabla de Contenidos
- 1. Energía interna, calor y trabajo en reacciones químicas cotidianas
- 2. Entalpías de reacciones químicas y ley de Hess
- 3. Primera ley de la termodinámica en sistemas agrícolas termorregulados y fomento de la producción ecológica
- 4. Segunda ley de la termodinámica y el ciclo de Carnot en máquinas térmicas
- 5. Leyes de Faraday de la electrólisis
- 6. Galvanoplastia como medio de producción sociocomunitaria
- 7. Celdas galvánicas, celdas electrolíticas y baterías de uso cotidiano
- 8. Balanceo de reacciones electroquímicas
1. Energía interna, calor y trabajo en reacciones químicas cotidianas
REACCIONES QUÍMICAS
EN LA NATURALEZA ocurren continuamente cambios químicos que pueden pasar inadvertidos para los que no son especialistas en la disciplina. Difícilmente se puede estar consciente, por ejemplo, de las innumerables reacciones químicas que ocurren en nuestro cuerpo relacionadas con la respiración, el crecimiento, la alimentación, la reproducción, etcétera.
Las plantas verdes, por ejemplo, absorben dióxido de carbono (CO2) de la atmósfera y con la energía proveniente del Sol, el agua y la clorofila (pigmento que les da el color verde), son capaces de producir azúcares y oxígeno libre. Este complicado proceso químico de la naturaleza se llama fotosíntesis.
12 H2O + 6 CO2 ® C6H12O6 + 6 O2 + 6 H2O
Los animales que se alimentan de plantas verdes, ingieren azúcares y otros productos químicos elaborados por las plantas, y de esta manera obtienen la energía que requieren para el desarrollo de sus funciones vitales. Este cambio químico, que ocurre en los animales, devuelve al ambiente agua y dióxido de carbono en la expiración.
La investigación química y el desarrollo tecnológico producen continuamente nuevos materiales: detergentes, colorantes, aromatizantes, conservadores, plásticos, etcétera.
Sin la química no habría automóviles, fotografía, televisores, materiales sintéticos, cosméticos, ni muchas otras cosas que utilizamos diariamente.
Las expectativas de vida se han incrementado gracias a la producción de nuevos fármacos (medicamentos). Muchas enfermedades mortales han sido eliminadas debido al desarrollo de métodos químicos y bioquímicos para su control y desaparición. Actualmente, cientos de profesionales se dedican afanosamente a la búsqueda de remedios y/o vacunas para el síndrome de inmuno deficiencia adquirida.
También es importante reconocer que existen procesos químicos y tecnológicos que conllevan resultados perjudiciales para la salud de los seres vivos, por ejemplo, la contaminación, la producción de basura, los efectos secundarios de algunos pesticidas, etc., que amenazan a nuestro planeta y pueden causar que se vuelva inhabitable.
El conocimiento de las reacciones químicas es importante, no sólo para los especialistas sino también para la sociedad, ya que ayuda a crear una conciencia sana y responsable en la preservación de nuestro medio ambiente y, en términos generales, de la vida en nuestro planeta.
Para poder conocer un poco de estos procesos es necesario ver de manera sencilla aquello que los químicos llaman reacción química.
Ya hemos visto que la materia (sólidos, líquidos y gases)está formada por átomos que a su vez se combinan con otros átomos y moléculas para producir muchas sustancias que conocemos y usamos. En la producción de nuevos compuestos, se absorbe o se desprende calor.
Se llama termoquímica al estudio de los cambios de calor que ocurren durante una reacción química. Ya hemos visto que la cantidad de calor que se transfiere de un sistema a otro se identifica con la letra Q. Cuando en una reacción química el calor ha entrado al sistema, Q es positivo y a la reacción química se le llama endotérmica; si el sistema pierde calor; Q es negativo y la reacción se llama exotérmica.
En la introducción de este libro hemos mencionado el fenómeno de la combustión. La combustión es un caso particular de las reacciones de oxidación en las cuales una sustancia (o elemento) reacciona con el oxígeno. Para ilustrarlo veamos la reacción de oxidación de un metal:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Es bien conocido que si se deja un metal, por tiempo prolongado, expuesto al aire, su superficie se transforma por la formación del óxido. Por ejemplo, los clavos "oxidados" recubiertos de herrumbre. Esta oxidación de la superficie se llama corrosión. En el caso de nuestro ejemplo, la humedad es un factor importante en la aceleración de la formación del óxido de fierro. Por la corrosión, al transcurrir el tiempo, pueden descomponerse o utilizarse maquinarias, transportes, reactores, etc. En nuestro país, la sola corrosión del metal fierro ocasiona pérdidas por millones o billones de pesos.
Los especialistas en corrosión, mediante el estudio de las reacciones químicas, pueden detener y a veces eliminar estos efectos cuando son indeseables.
Algunos metales, como el cinc, níquel, aluminio y el cromo, entre otros, no necesitan ser protegidos de manera especial contra la corrosión, bien sea porque no se oxidan con el aire (el aire contiene 1/5 parte de oxígeno) o porque cuando se forma una capa muy delgada del óxido, éste mismo sirve de protección al resto del material para que no se siga oxidando. Por esta razón se usan como metales protectores de otras superficies más vulnerables a los efectos de la corrosión. Actualmente se usan también materiales plásticos para recubrir y proteger superficies contra estos efectos.
El lenguaje simbólico de la química
En párrafos anteriores escribimos una reacción de oxidación de la siguiente manera:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Para representar esta reacción de manera más económica y hacerla más explícita, se utilizan los símbolos de los elementos y las fórmulas químicas de los compuestos. Tomemos como ejemplo de un metal al mercurio, cuyo símbolo es Hg. La reacción química de oxidación del mercurio se expresaría en el lenguaje de la química:
![]()
Traduzcamos ahora, al lenguaje común, toda la información contenida en esta ecuación química. Primero veremos el significado de la ecuación y más adelante trataremos la información contenida en el recuadro.
Hg es el símbolo del mercurio y proviene del nombre original que se le dio en latín a este elemento: hydrargirium (que en español quiere decir plata líquida). Hg es, por lo tanto, una abreviatura del nombre.
(s) es una abreviatura de la palabra sólido.
(+) este signo, igual al de "suma" en las ecuaciones matemáticas, indica que el mercurio se unirá o combinará con el elemento que sigue a continuación.
(O2) O es el símbolo del oxígeno y el número 2 indica que se trata de una molécula de oxígeno formada por 2 átomos.
(g) indica que el oxígeno está en estado gaseoso.
La flecha sustituye al signo = de nuestra ecuación original simplemente porque la flecha puede hacerse del tamaño que se desea y a veces se puede poner información adicional sobre ella. En realidad no necesita mayor justificación: ¡los químicos la prefieren!
A los elementos a la izquierda de la flecha, en nuestro caso el Hg y el O2, se les suele llamar reactivos, y a los que están en el lado derecho de la flecha, productos. Quizá con esto hemos encontrado una justificación al uso de la flecha; los químicos dicen: "El mercurio al reaccionar con el oxígeno produce óxido de mercurio." Así pues, la flecha está en lugar de la palabra produce, el uso del signo = sería incorrecto, ya que de ninguna manera el mercurio y el oxígeno como elementos son "iguales" al óxido de mercurio, que es un compuesto.
Es importante saber si en una reacción química los productos pueden volver a reaccionar para formar los reactivos originales. Cuando esto sucede, se coloca en la ecuación una segunda flecha en sentido contrario:
A + BEn este caso se dice que la reacción es reversible: puede ocurrir de derecha a izquierda y viceversa. Un ejemplo de una reacción reversible es la del hierro (Fe) con vapor de agua para producir el óxido de hierro 11-111 (Fe3O4) e hidrógeno (H2):
3 Fe + 4 H2O ![]() Fe3 O4 + 4 H2
Fe3 O4 + 4 H2
A + B ![]() C + D,
C + D,
cuando ambas reacciones llegan a un estado en el cual se están formando C y D por reacción de A con B, con la misma rapidez que se combinan C y D para formar nuevamente A y B, se dice que se ha alcanzado un estado de equilibrio dinámico. Este equilibrio es función de la temperatura, de la presión y de las cantidades en exceso de reactivos o productos que puedan estar presentes.
En todas las reacciones químicas ocurren cambios de energía, es decii; se puede absorber o liberar energía en forma de calor, luz, energía eléctrica, etcétera.
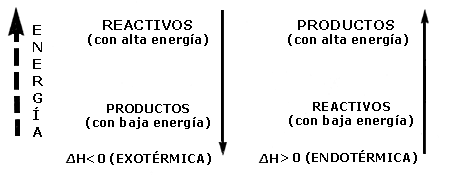
Si en una reacción se libera energía en forma de calor; decimos que la reacción es exotérmica; si la energía es absorbida, entonces la reacción es endotérmica.
La manera de expresar esto en el lenguaje de las reacciones químicas es mediante el símbolo DH (cambio de entalpía), que precedido de un signo negativo (-DH) indica que la energía es liberada; otra forma de expresar lo mismo es DH < O, esto es, que DH es menor que cero. Si en la reacción se absorbe energía, se antepone un signo + (+DH) o bien en su forma equivalente DH > O (DH es mayor que cero).
Ejemplos:
El símbolo H representa la entalpía del sistema y es una función con propiedades semejantes a la energía interna (U). Cuando los procesos se llevan a cabo a presión constante, es más conveniente utilizar la función entalpía.3
Un ejemplo de una reacción exotérmica común es la combustión del gas natural:
CH4(g) + 2 O2(g) => CO2(g) + 2H2O(l); DH < 0
Se obtienen unas 13 300 calorías por cada gramo de metano (CH4) quemado.
Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, donde las radiaciones ultravioleta proveen la energía del Sol. También ocurre cerca de descargas eléctricas (cuando se producen tormentas eléctricas):
El olor del ozono puede usted reconocerlo aun en pequeñas cantidades, por ejemplo: cuando un tren eléctrico de juguete está en operación y saltan chispas. Es un olor
ENERGÍA INTERNA ( U ).Energía interna es la energía total de los componentes de un sistema y es la suma de todos los tipos de energía que puedan tener los componentes de dicho sistema: energías de los enlaces, de traslación y rotación de las moléculas, vibración de los átomos, etc. La energía interna es una función de estado que se representa por la letra U. Es por definición imposible de calcular el valor absoluto para un sistema en un estado determinado, solo se puede afirma que depende de la temperatura a la que se encuentra siendo mayor la energía interna del sistema cuanto mayor es la temperatura a la que se encuentra. Pero si se puede calcular la variación entre dos estados
CALOR DE REACCIÓN ( Q ).
Es el calor absorbido o desprendido en un proceso o reacción química. Por
convenio, se le asigna signo positivo si fluye del entorno al sistema y negativo si va
del sistema al entorno.
Si el proceso químico conlleva una absorción de energía del sistema en forma
de calor se llama endotérmico. Y si la cede exotérmico.
1.1. Trabajo y calor en termodinámica
2. Entalpías de reacciones químicas y ley de Hess
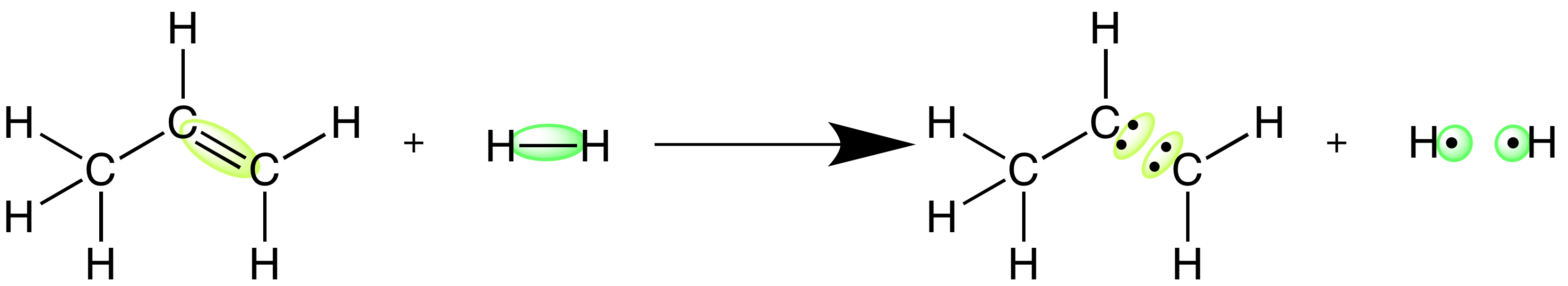
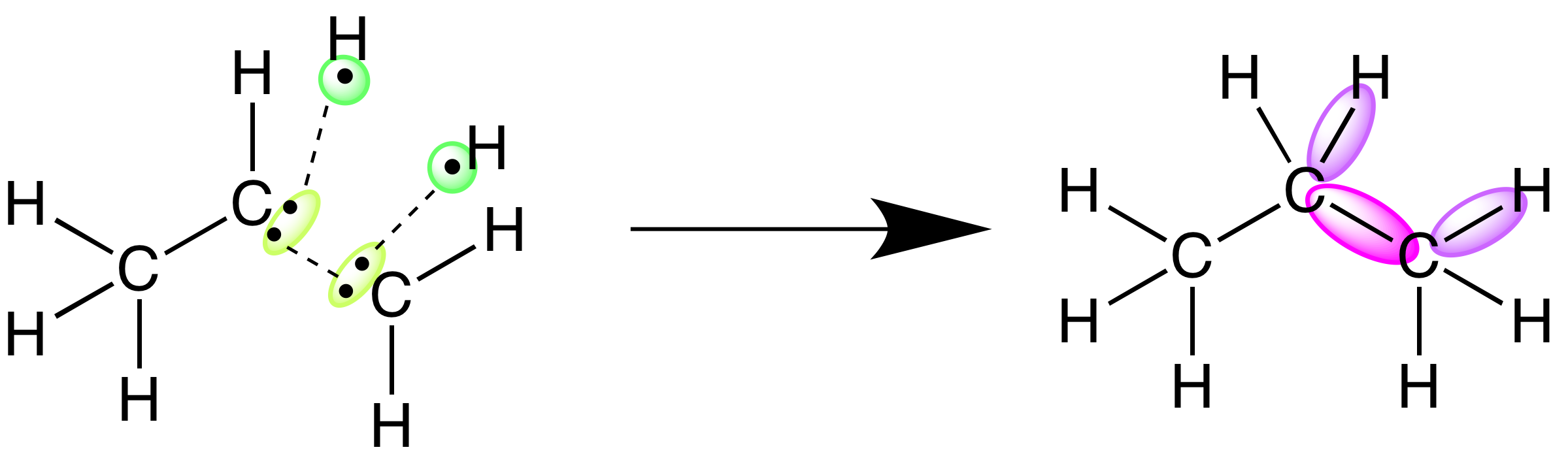
Los enlaces químicos representan energía potencial. Cuantificar la energía que representan los enlaces de diferentes moléculas es una parte importante de la comprensión de la energía total implicada en una reacción. En el presente artículo vamos a explorar dos conceptos diferentes que ayudan a describir esa energía: la entalpía de reacción y la entalpía de enlace.
Entalpía de reacción

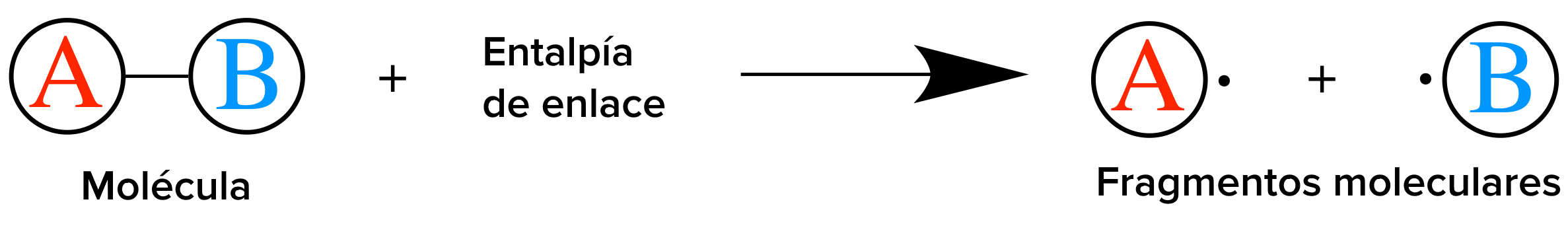
3. Primera ley de la termodinámica en sistemas agrícolas termorregulados y fomento de la producción ecológica
Primera Ley de la Termodinámica
La primera ley de la termodinámica, es la aplicación del principio de conservación de la energía, a los procesos de calor y termodinámico:

La primera ley hace uso de los conceptos claves de energía interna, calor, y trabajo sobre un sistema. Usa extensamente el estudio de los motores térmicos. La unidad estándar de todas estas cantidades es el julio, aunque algunas veces se expresan en calorías o BTU.
En los textos de Química es típico escribir la primera ley como ΔU=Q+W. Por supuesto que es la misma ley, -la expresión termodinámica del principio de conservación de la energía-. Exactamente se define W, como el trabajo realizado sobre el sistema, en vez de trabajo realizado por el sistema. En un contexto físico, el escenario común es el de añadir calor a un volumen de gas, y usar la expansión de ese gas para realizar trabajo, como en el caso del empuje de un pistón, en un motor de combustión interna. En el contexto de procesos y reacciones químicas, suelen ser mas comunes, encontrarse con situaciones donde el trabajo se realiza sobre el sistema, mas que el realizado por el sistema.
1era Ley de la Termodinamica.
4. Segunda ley de la termodinámica y el ciclo de Carnot en máquinas térmicas

Máquinas térmicas y la segunda ley de la termodinámica La segunda ley de la termodinámica establece cuáles procesos pueden ocurrir y cuáles no en la naturaleza. Los siguientes son ejemplos de procesos que son consistentes con la primera ley de la termodinámica pero que proceden de un orden gobernado por la segunda ley: Cuando dos objetos a diferente temperatura se ponen en contacto térmico entre sí, la energía térmica siempre fluye del objeto más caliente al más frío, nunca del más frío al más caliente. Una bola de hule que se deja caer al suelo rebota varias veces y finalmente queda en reposo, pero una bola que se encuentra en el suelo nunca empieza a botar por sí sola. Debido a los choques con las moléculas de aire y la fricción, un péndulo oscilante finalmente se detiene en el punto de suspensión. La energía mecánica se convierte en energía térmica; la transformación inversa de energía nunca ocurre.
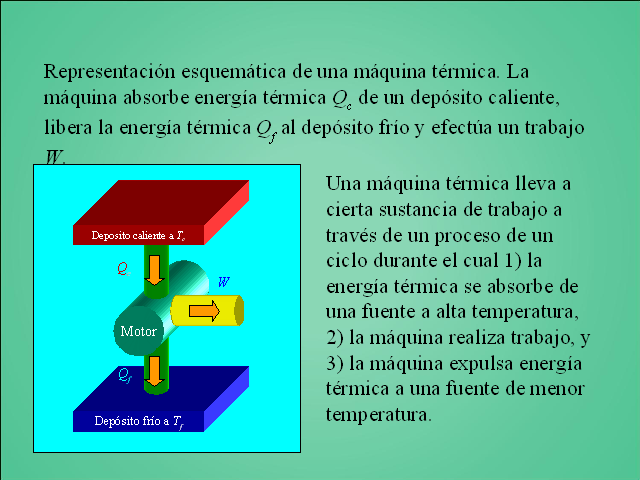
Representación esquemática de una máquina térmica. La máquina absorbe energía térmica Qc de un depósito caliente, libera la energía térmica Qf al depósito frío y efectúa un trabajo W. Una máquina térmica lleva a cierta sustancia de trabajo a través de un proceso de un ciclo durante el cual
1) la energía térmica se absorbe de una fuente a alta temperatura,
2) la máquina realiza trabajo, y
3) la máquina expulsa energía térmica a una fuente de menor temperatura. Depósito frío a Tf Motor Deposito caliente a Tc Qc Qf W
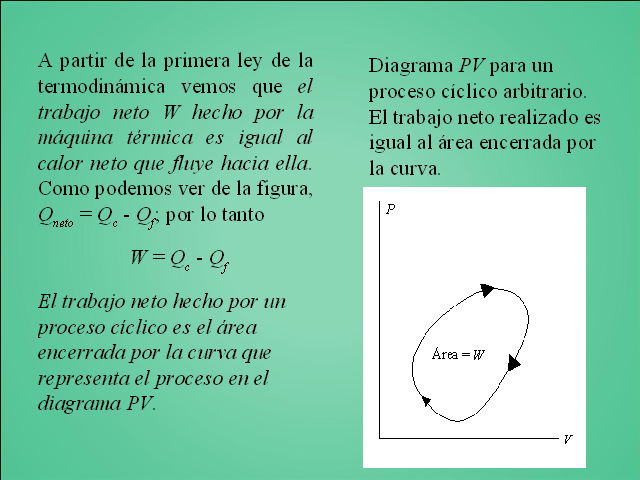
A partir de la primera ley de la termodinámica vemos que el trabajo neto W hecho por la máquina térmica es igual al calor neto que fluye hacia ella. Como podemos ver de la figura, Qneto = Qc - Qf; por lo tanto W = Qc - Qf El trabajo neto hecho por un proceso cíclico es el área encerrada por la curva que representa el proceso en el diagrama PV. Diagrama PV para un proceso cíclico arbitrario. El trabajo neto realizado es igual al área encerrada por la curva.

La eficiencia térmica, e, de una máquina térmica se define como el cociente del trabajo neto realizado a la energía térmica absorbida a una temperatura más alta durante el ciclo: Esta fórmula muestra que una máquina tiene un 100% de eficiencia sólo sí Qf = 0. Es decir, no se entrega energía térmica al reservorio frío. 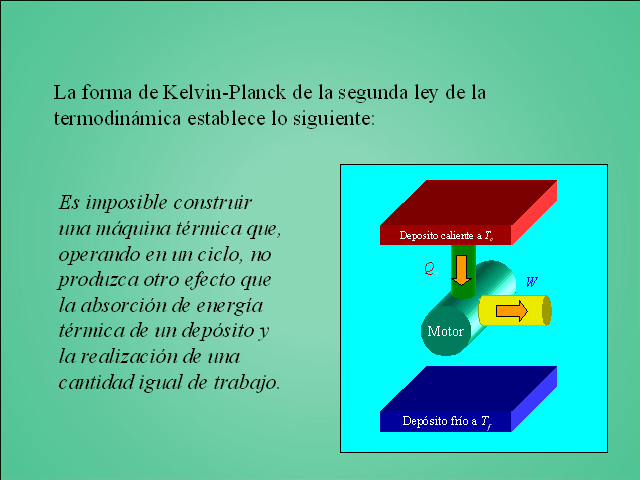
La forma de Kelvin-Planck de la segunda ley de la termodinámica establece lo siguiente: Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía térmica de un depósito y la realización de una cantidad igual de trabajo. Depósito frío a Tf Motor Deposito caliente a Tc Qc W

Ejemplo Calcule la eficiencia de una máquina térmica que absorbe 2000 J de energía de un depósito caliente y entrega 1500 J a un depósito frío.
5. Leyes de Faraday de la electrólisis
Leyes de Faraday de la Electrólisis
La cantidad de masa depositada en un electrodo es proporcional a la cantidad de electricidad que ha circulado por el electrodo:
- masa desprendida = k (constante) · Q = k · I · t
La cantidad de masa depositada de un elemento en un electrodo es proporcional a su peso equivalente (peso atómico dividido entre su número de oxidación):
- masa desprendida = k (constante)· peso atómico / nº oxidación
La cantidad de electricidad que es necesaria para que se deposite 1 equivalente gramo de un elemento es F = 96500 culombios (constante de Faraday). Como 1 equivalente gramo es igual al peso atómico / nº de oxidación en gramos:
- masa desprendida = I · t · (peso atómico / nº de oxidación) / 96500
En una electrólisis de 3 disoluciones de CuCl2 , NaCl y FeCl3 , calcular la cantidad de cobre, sodio e hierro que se depositan en los electrodos por el paso de una corriente de 3 Amperios durante 5 minutos.
Solución: En las cubas o celdas electrolíticas las sustancias se encuentran disueltas en iones:
- CuCl2 →
Cu+2 + 2 Cl- - NaCl → Na+ + Cl-
- FeCl3 → Fe+3 + 3 Cl-
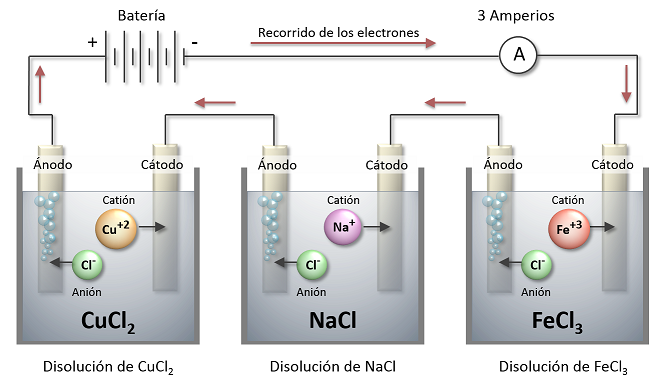
Aplicando la fórmula de la 3ª Ley de Faraday de la Electrólisis obtenemos las masas depositadas en los electrodos negativos (cátodos):
- masa depositada de cobre = [3 amperios · 300 segundos · (65,55 / 2)] / 96500 = 0,3 gramos
- masa depositada de sodio = [3 amperios · 300 segundos · (22,99 / 1)] / 96500 = 0,21 gramos
- masa depositada de hierro = [3 amperios · 300 segundos · (55,84 / 3)] / 96500 = 0,17 gramos
5.1. Celdas electrolíticas. Leyes de Faraday de la electrólisis
6. Galvanoplastia como medio de producción sociocomunitaria
Galvanoplastia: Procesos, Aplicaciones y Ejemplos
La galvanoplastia es una técnica que usa la electrodeposición de metales en el revestimiento de un electrodo, para crear sobre este una superficie con características distintas a las del metal en su estado puro. En la galvanoplastia también se usan procesos de enchapado e inmersión, que no involucran el uso de una corriente eléctrica.
La electrodeposición, técnica usada en la galvanoplastia, consiste en un proceso electroquímico que se emplea para crear un recubrimiento metálico sobre una superficie conductora, mediante la precipitación de cationes del metal presentes en una solución acuosa.
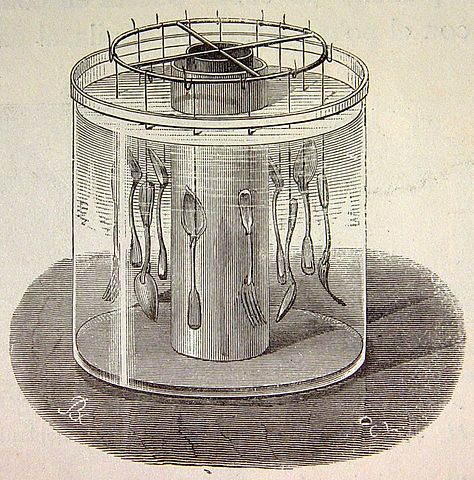
Aunque la galvanoplastia se aplica desde hace muchos años, en sus inicios se utilizaba con fines principalmente decorativos, hasta que a partir de la Primera y Segunda Guerra Mundial, comenzó a emplearse como tecnología en la industria electrónica, en la metalurgia, en la electroquímica, y en muchos otros campos.
¿En qué consiste la galvanoplastia?
Como se describió previamente, la galvanoplastia consiste en la modificación de las características de la superficie de ciertos materiales a través de la acumulación de metales sobre esta por deposición.
De esta manera, las propiedades se modifican mediante la formación de una capa o recubrimiento sobre el material, utilizando el mismo principio de las celdas electrolíticas, donde la superficie que se desea galvanizar funciona como la parte catódica del circuito, mientras que el ánodo está constituido por el metal que se electrodepositará sobre la pieza.
Tanto el ánodo como el cátodo están inmersos en una solución que está compuesta por una o varias sales de metales disueltas, así como algunas especies iónicas que contribuyen al flujo de la corriente eléctrica.
Por un lado, el ánodo recibe el flujo de corriente y produce la oxidación las especies metálicas de las que está constituido, ayudando a que se disuelvan en el electrolito.
Por otro lado, en el cátodo se origina la reducción de los iones de los metales que se han disuelto en la interfase formada entre el cátodo y el electrolito, para que así puedan “extenderse” hacia el cátodo.
Procesos relacionados con la galvanoplastia
Electrodeposición por barrido
Es una técnica íntimamente relacionada con la galvanoplastia, en la cual se recubren zonas específicas e incluso objetos completos empleando una brocha saturada de la solución de revestimiento.
Esta brocha está hecha de acero inoxidable y cubierta en una tela absorbente, la cual mantiene dentro la solución de revestimiento e impide el contacto directo con el material que se recubre. Se empapa en la solución y se aplica de manera uniforme en el material.
Electrodeposición por impulsos
Este método es una alteración sencilla al concepto de electrodeposición, y consiste en la variación de la corriente o el potencial de manera rápida entre dos valores distintos, de los cuales resulta una cadena de pulsos que poseen la misma polaridad, duración y amplitud, y que están divididos por una corriente cuyo valor es igual a cero.
Si se modifican el ancho o la amplitud del impulso mientras se utilice este procedimiento, se puede alterar también el espesor e incluso la composición de la capa de revestimiento que se deposita.
Deposición electroquímica
De manera similar, la deposición electroquímica es empleada normalmente para conducir óxidos de metales y para la acumulación de metales en ciertas superficies por las ventajas que presenta, como su bajo costo con relación a otras técnicas o que no necesita altas temperatura de procesado
Es ampliamente utilizada en la síntesis de recubrimientos relativamente compactos y uniformes de determinadas estructuras basadas en un modelo, y también para la obtención de mayores tasas de deposición de metales, entre otras aplicaciones.
Strike
Existe un proceso llamado strike que se basa en el uso de un sedimento con características especiales para recubrimiento, con el fin de producir un revestimiento bastante delgado que se adhiera bien al sustrato y que presente alta calidad.
Esta técnica ofrece una buena base para revestimientos posteriores y, a su vez, puede combinarse con otros métodos para obtener un mejor resultado.
Aplicaciones de la galvanoplastia
Se conoce un gran número de aplicaciones que se le han dado a este proceso de electrodeposición. A continuación describiremos las más destacadas:
– Aumento del espesor en objetos o piezas con dimensiones insuficientes para funciones determinadas en la industria.
– Reforzamiento de propiedades como la dureza o resistencia de ciertos metales a través de recubrimientos sucesivos.
– Fabricación de piezas por electroformación (método para la creación de piezas metálicas por la acumulación de metales sobre patrones específicos).
– Reproducción de elementos decorativos mediante técnicas electroquímicas empleando diferentes metales.
– Protección de diversos materiales a través del revestimiento de su superficie mediante películas protectoras de aleaciones de metales.

Ejemplos
En la vida diaria se observan diversos usos de la galvanoplastia, siendo uno de los más comunes la producción de monedas (que están forjadas con zinc) con revestimiento de cobre para protegerlas de la corrosión.
Otro ejemplo que se puede observar a menudo es el recubrimiento de piezas de hierro con películas de zinc, para evitar que estas sean oxidadas cuando son expuestas al oxígeno presente en el aire.
En el caso de los elementos ornamentales, se encuentra el revestimiento de joyas con metales preciosos como oro o plata, así como otros más difíciles de conseguir dependiendo del fin que se desee.
Finalmente, además de la existencia de muchos otros ejemplos del empleo de esta útil técnica, se tiene el niquelado (recubrimiento con níquel) de objetos de acero con el fin de potenciar sus capacidades anticorrosivas.
7. Celdas galvánicas, celdas electrolíticas y baterías de uso cotidiano
Una celda electro-química es un dispositivo capaz de obtener energía eléctrica a partir de reacciones químicas (o bien, de producir reacciones químicas a través de la introducción de energía eléctrica, cuando se esté cargando la celda). Un ejemplo común de celda electroquímica es la pila (por ejemplo, la estándar de 1,5 voltios o la recargable de 1,2), que es una celda galvánica simple, mientras una batería eléctrica consta de varias celdas conectadas en serie o paralelo.

Un diagrama de celda electroquímica de configuración semejante a la pila Daniell. Las dos semiceldas están unidas por un puente salino que permite a los iones moverse entre ambos. Los electrones fluyen por el circuito externo.
Johann Wilhelm Ritter, un físico y filósofo alemán, construyó en 1802 la primera celda electroquímica, con 50 discos de cobre separados por discos de cartón humedecidos por una solución salina.
Tipos de celdas electro-químicas
Hay dos tipos fundamentales de celdas y en ambas tiene lugar una reacción redox, y la conversión o transformación de un tipo de energía en otra:
- La celda galvánica o celda voltaica transforma una reacción química espontánea en una corriente eléctrica, como las pilas y baterías. Son muy empleadas por lo que la mayoría de los ejemplos e imágenes de este artículo están referidos a ellas.
- La celda electrolítica transforma una corriente eléctrica en una reacción química de oxidación-reducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrólisis. También se la conoce como cuba electrolítica. A diferencia de la celda voltaica, en la celda electrolítica, los dos electrodos no necesitan estar separados, por lo que hay un solo recipiente en el que tienen lugar las dos semirreacciones.
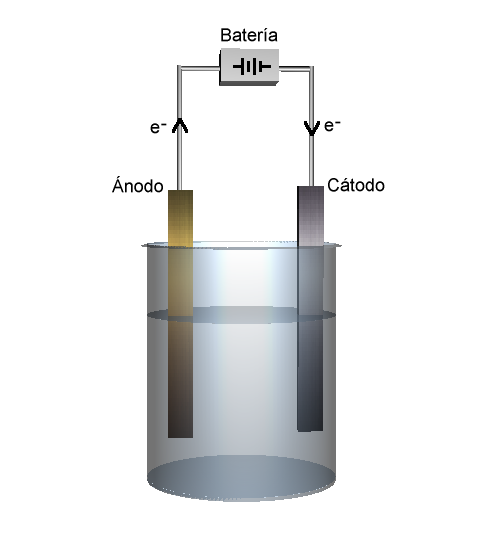
Las semiceldas o semirreacciones en una celda voltaica
Una celda galvánica o celda voltaica consta de dos semiceldas conectadas eléctricamente mediante un conductor metálico, y también mediante un puente salino. Cada semicelda consta de un electrodo y un electrolito. Las dos semiceldas pueden utilizar el mismo electrolito, o pueden utilizar electrolitos diferentes. Las reacciones químicas en la celda pueden implicar al electrolito, a los electrodos o a una sustancia externa (como en las pilas de combustible que puede utilizar el hidrógeno gaseoso como reactivo). En una celda voltaica completa, las especies químicas de una semicelda pierden electrones (oxidación) hacia su electrodo mientras que las especies de la otra semicelda ganan electrones (reducción) desde su electrodo. Un puente salino se emplea a menudo para proporcionar un contacto iónico entre las dos medias celdas con electrolitos diferentes, para evitar que las soluciones se mezclen y provoquen reacciones colaterales no deseadas. Este puente salino puede ser simplemente una tira de papel de filtro empapado en solución saturada de nitrato de potasio. Otros dispositivos para lograr la separación de las disoluciones son vasijas porosas y disoluciones gelificadas. Un recipiente poroso se utiliza en la pila de Bunsen (derecha).
También se les denomina semirreacciones pues en cada una de ella tiene lugar una parte de la reacción redox:
- La pérdida de electrones (oxidación) tiene lugar en el ánodo.
- La ganancia de electrones (reducción) en el cátodo.
Reacción de equilibrio
Cada semicelda tiene una tensión característica llamada potencial de semicelda o potencial de reducción. Las diferentes sustancias que pueden ser escogidas para cada semicelda dan lugar a distintas diferencias de potencial de la celda completa, que es el parámetro que puede ser medido. No se puede medir el potencial de cada semicelda, sino la diferencia entres los potenciales de ambas. Cada reacción está experimentando una reacción de equilibrio entre los diferentes estados de oxidación de los iones; cuando se alcanza el equilibrio, la célula no puede proporcionar más tensión. En la semicelda que está sufriendo la oxidación, cuanto más cerca del equilibrio se encuentra el ion/átomo con el estado de oxidación más positivo, tanto más potencial va a dar esta reacción. Del mismo modo, en la reacción de reducción, cuanto más lejos del equilibrio se encuentra el ion/átomo con el estado de oxidación más negativo, más alto es el potencial.
Potenciales de electrodo y fuerza electromotriz de una pila
El potencial o fuerza electromotriz de una pila se puede predecir a través de la utilización de los potenciales de electrodo, las tensiones de cada semicelda. (Ver tabla de potenciales de electrodo estándar). La diferencia de voltaje entre los potenciales de reducción de cada electrodo da una predicción para el potencial medido de la pila.
Los potenciales de pila tienen un rango posible desde 0 hasta 6 voltios. Las pilas que usan electrolitos disueltos en agua generalmente tienen potenciales de celda menores de 2,5 voltios, ya que los oxidantes y reductores muy potentes, que se requerirían para producir un mayor potencial, tienden a reaccionar con el agua.
Tipos de celdas galvánicas
Las celdas o células galvánicas se clasifican en dos grandes categorías:
- Las celdas primarias transforman la energía química en energía eléctrica, de manera irreversible (dentro de los límites de la práctica). Cuando se agota la cantidad inicial de reactivos presentes en la pila, la energía no puede ser fácilmente restaurada o devuelta a la celda electroquímica por medios eléctricos.
- Las celdas secundarias pueden ser recargadas, es decir, que pueden revertir sus reacciones químicas mediante el suministro de energía eléctrica a la celda, hasta el restablecimiento de su composición original.
Celdas galvánicas primarias
Las celdas galvánicas primarias pueden producir corriente inmediatamente después de su conexión. Las pilas desechables están destinadas a ser utilizadas una sola vez y son desechadas posteriormente. Las pilas desechables no pueden ser recargadas de forma fiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos no pueden volver a su forma original.

Generalmente, tienen densidades de energía más altas que las pilas recargables, pero las células desechables no van bien en aplicaciones de alto drenaje con cargas menores de 75 ohmios (75 Ω).
Celdas galvánicas secundarias
Las celdas galvánicas secundarias debe ser cargadas antes de su uso; por lo general son ensambladas con materiales y objetos activos en el estado de baja energía (descarga). Las celdas galvánicas recargables o pilas galvánicas secundarias se pueden regenerar (coloquialmente, recargar) mediante la aplicación de una corriente eléctrica, que invierte la reacciones químicas que se producen durante su uso. Los dispositivos para el suministro adecuado de tales corrientes que regeneran las sustancias activas que contienen la pila o batería se llaman, de modo inapropiado, cargadores o recargadores.

La forma más antigua de pila recargable es la batería de plomo-ácido. Esta celda electroquímica es notable, ya que contiene un líquido ácido en un recipiente sellado, lo cual requiere que la celda se mantenga en posición vertical y la zona de estar bien ventilada para garantizar la seguridad de la dispersión del gas hidrógeno producido por estas células durante la sobrecarga. La celda de plomo-ácido es también muy pesada para la cantidad de energía eléctrica que puede suministrar. A pesar de ello, su bajo costo de fabricación y sus niveles de corriente de gran aumento hacen que su utilización sea común cuando se requiere una gran capacidad (más de 10A·h) o cuando no importan el peso y la escasa facilidad de manejo.
Un tipo mejorado de la celda de electrolito líquido es la celda de plomo-ácido regulada por válvula de sellado (VRLA,por sus siglas en inglés), popular en la industria del automóvil como un sustituto para la celda húmeda de plomo-ácido, porque no necesita mantenimiento. La celda VRLA utiliza ácido sulfúrico inmovilizado como electrolito, reduciendo la posibilidad de fugas y ampliando la vida útil. Se ha conseguido inmovilizar el electrolito, generalmente por alguna de estas dos formas:
- Celdas de gel que contienen un electrolito semi-sólido para evitar derrames.
- Celdas de fieltro de fibra de vidrio absorbente, que absorben el electrolito en un material absorbente realizado con fibra de vidrio especial.
Otras células portátiles recargables son (en orden de densidad de potencia y, por tanto, de coste cada vez mayores): celda de níquel-cadmio (Ni-Cd), celda de níquel metal hidruro (NiMH) y celda de iones de litio (Li-ion). Por el momento, las celdas de ion litio tienen la mayor cuota de mercado entre las pilas secas recargables. Mientras tanto, las pilas de NiMH han sustituido a las de Ni-Cd en la mayoría de las aplicaciones debido a su mayor capacidad, pero las de NiCd siguen usándose en herramientas eléctricas, radios de dos vías, y equipos médicos.
Celda galvánica
La celda galvánica o celda voltaica, denominada en honor de Luigi Galvani y Alessandro Volta respectivamente, es una celda electroquímica que obtiene la energía eléctrica a partir de reacciones redox espontáneas que tienen lugar dentro de la misma. Por lo general, consta de dos metales diferentes conectados por un puente salino, o semiceldas individuales separadas por una membrana porosa. Volta fue el inventor de la pila voltaica, la primera pila eléctrica.
En el uso común, la palabra pila es una celda galvánica única y una batería propiamente dicha consta de varias celdas, conectadas en serie o paralelo.
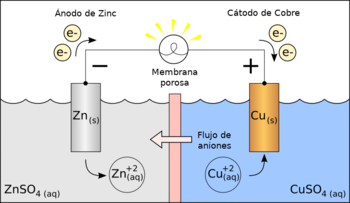
Una celda galvánica consta de dos semipilas (denominadas también semiceldas o electrodos). En su forma más simple, cada semipila consta de un metal y una solución de una sal del metal. La solución de la sal contiene un catión del metal y un anión para equilibrar la carga del catión. En esencia, la semipila contiene el metal en dos estados de oxidación, y la reacción química en la semipila es una reacción redox, escrita simbólicamente en el sentido de la reducción como:
- M n+ (especie oxidada) + n e-
M (especie reducida)
En una pila galvánica un metal es capaz de reducir el catión del otro, y, por el contrario, el otro catión puede oxidar al primer metal. Las dos semipilas deben estar separadas físicamente de manera que las soluciones no se mezclen. Se utiliza un puente salino o una placa porosa para separar las dos soluciones.
El número de electrones transferidos en ambas direcciones debe ser el mismo; así las dos semipilas se combinan para dar la reacción electroquímica global de la celda. Para dos metales, A y B:
- A n+ + n e-
A.
- B m+ + m e-
B.
- m A + n B m+
n B + m A n+
Esto no es toda la historia, ya que los aniones también deben ser transferidos de una semicelda a la otra. Cuando un metal se oxida en una semipila, deben transferirse aniones a la semipila para equilibrar la carga eléctrica del catión producido. Los aniones son liberados de la otra semipila cuando un catión se reduce al estado metálico. Por lo tanto, el puente salino o la membrana porosa sirven tanto para mantener las soluciones separadas como para permitir el flujo de aniones en la dirección opuesta al flujo de electrones en el cable de conexión de los electrodos.
El voltaje de la pila galvánica es la suma de los potenciales de las dos semipilas. Se mide conectando un voltímetro a los dos electrodos. El voltímetro tiene una resistencia muy alta, por lo que el flujo de corriente es realmente insignificante. Cuando un dispositivo como un motor eléctrico se conecta a los electrodos fluye una corriente eléctrica y las reacciones redox se producen en ambas semipilas. Esto continuará hasta que la concentración de los cationes que se reducen se aproxime a cero.
Para la pila galvánica, representada en la figura, los dos metales son zinc y cobre, y las dos sales son los sulfatos del metal correspondiente. El zinc es el metal más reductor, de modo que, cuando un dispositivo se conecta a ambos electrodos, la reacción electroquímica es
- Zn + Cu2+
Zn2+ + Cu
El electrodo de zinc se disuelve y el cobre se deposita en el electrodo de cobre. Por definición, el cátodo es el electrodo donde tiene lugar la reducción (ganancia de electrones), por lo que el electrodo de cobre es el cátodo. El ánodo atrae cationes, que tienen una carga positiva, por lo que el ánodo es el electrodo negativo. En este caso el cobre es el cátodo y el zinc es el ánodo.
Las celdas galvánicas se usan normalmente como fuente de energía eléctrica. Por su propia naturaleza producen corriente. Por ejemplo, una batería de plomo y ácido contiene un número de celdas galvánicas. Los dos electrodos son efectivamente plomo y óxido de plomo.
La celda Weston se adoptó como un estándar internacional para el voltaje en 1911. El ánodo es una amalgama de mercurio (elemento) y cadmio, el cátodo está hecho de mercurio puro, el electrólito es una solución (saturada) de sulfato de cadmio y el despolarizador es una pasta de sulfato de mercurio (I). Cuando la solución de electrólito está saturada el voltaje de la celda es muy reproducible; de ahí su uso como un estándar.
8. Balanceo de reacciones electroquímicas
Reacciones Óxido-Reducción (REDOX)
Las reacciones de oxidación-reducción forman una parte importante del mundo que nos rodea. Abarcan desde la combustión de combustibles fósiles hasta la acción de los blanqueadores de ropa domésticos. Asimismo, la mayoría de los elementos metálicos y no metálicos se obtienen de sus minerales por procesos de oxidación o de reducción. Hay muchos fenómenos que se dan a tu alrededor y en tu propio cuerpo relacionados con la química de los procesos de oxidación y reducción. Así, por ejemplo, los objetos metálicos se oxidan cuando están a la intemperie; al encender una estufa (no eléctrica) se produce calor por la oxidación del combustible; en tu propio cuerpo, las células oxidan las sustancias nutritivas presentes en los alimentos para obtener la energía que te permite vivir. Hay procesos biológicos tan importantes como la fotosíntesis y la respiración celular que en esencia serán reacciones redox. El primero involucra la reducción del dióxido de carbono atmosférico para producir glucosa, un compuesto altamente energético; el segundo, en cambio, oxida este monosacárido y libera la energía contenida en sus enlaces.
Las reacciones de oxidación -reducción se deben, principalmente, a la transferencia de electrones desde un agente reductor a un agente oxidante.
En una reacción REDOX u óxido reducción, una especie se oxida (cede electrones) y la otra especie se reduce (gana electrones). Como estas dos situaciones ocurren en la misma reacción, los electrones cedidos por la especie que se oxida, son empleados por la especie que se reduce, que debe ganar electrones.
Ejemplo de una reacción REDOX:
Cuando, se introduce una lámina de zinc, en una disolución concentrada de iones Cu2+, al cabo de unos segundos, ésta se recubre de una capa de cobre metálico.
La ecuación química que representa el proceso es:
![]()
La ecuación anterior nos indica, que durante el proceso, el átomo de zinc se ha transformado en el ion Zn2+, para lo cual ha tenido que ceder dos electrones; en cambio, el ion Cu2+ se ha convertido en un átomo de cobre, para lo cual ha debido aceptar dos electrones.
Sobre la base de esta información deducimos que la ecuación iónica anterior involucra dos procesos:
• En uno, se pierden electrones, y
• En el otro, se ganan electrones.
Las ecuaciones que describen estos procesos son:
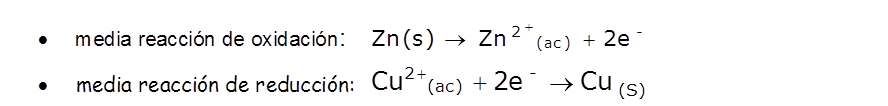
Por lo tanto, en el proceso de oxidación un átomo o un ion cede uno o más electrones; mientras que en el proceso de reducción, el átomo o el ion capta uno o más electrones. Ambos procesos son complementarios y ocurren simultáneamente.
En toda reacción REDOX, se tiene:
- un agente oxidante
- un agente reductor
- una especie oxidada
- una especie reducida
En las ecuaciones REDOX, el agente oxidante y el agente reductor, se encuentran siempre como reactantes; mientras que la especie oxidada y la especie reducida, se encuentran siempre como producto.
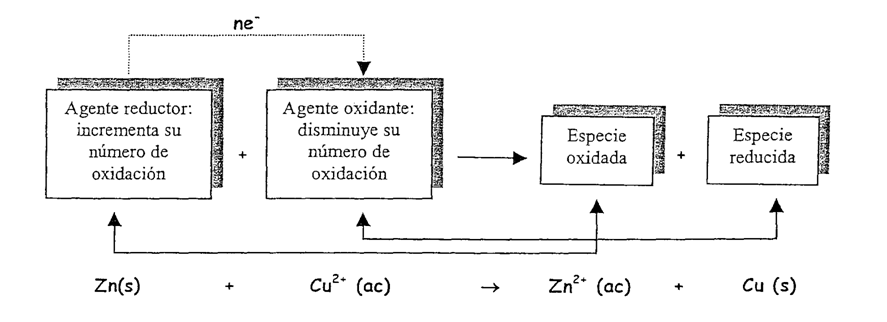
Agente oxidante
En toda reacción redox, el agente oxidante es la especie química que se reduce, es decir, la que recibe los electrones. Tengan en cuenta, que en la semir-reacción de reducción, se consumen los electrones.
En la ecuación, observamos que el ion cobre (Cu2+) se reduce, porque recibe los electrones que provienen del zinc y se convierte en cobre elemental, Cu(s) eléctricamente neutro.
Por lo tanto el ion Cu2+ es el agente oxidante.
Agente Reductor
En toda reacción redox, el agente reductor es la especie química que se oxida, es decir, la que cede electrones. Tengan en cuenta que en la semi-reacción de oxidación, se producirán electrones.
En la ecuación, el Zn(s) es el agente reductor, ya que en la semireacción se producen electrones, lo que significa que el zinc se oxida y se transforma Zn2+.
Por lo tanto el Zn, es el agente reductor.
Especie Oxidada
Será la especie que recibió los electrones, en nuestro ejemplo el Zn2+.
Especie Reducida
Será la especie que perdió los electrones, en nuestro ejemplo el Cu.