LA CIENCIA QUÍMICA COMO FUNDAMENTO DE LA VIDA EN LA MADRE TIERRA Y EL COSMOS
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 1° - Ciencias Naturales |
| Libro: | LA CIENCIA QUÍMICA COMO FUNDAMENTO DE LA VIDA EN LA MADRE TIERRA Y EL COSMOS |
| Impreso por: | Invitado |
| Fecha: | miércoles, 4 de diciembre de 2024, 19:22 |
1. Reseña histórica de la química
La historia de la química abarca un periodo de tiempo muy grande que va desde la prehistoria hasta el presente, y está ligada al desarrollo del hombre y su conocimiento de la naturaleza. Las civilizaciones antiguas ya usaban tecnologías que demostraban su conocimiento de las transformaciones de la materia, y algunas servirían de base a los primeros estudios de la química. Entre ellas se cuentan la extracción de los metales de sus menas, la elaboración de aleaciones como el bronce, la fabricación de cerámica, esmaltes y vidrio, la fermentación de la cerveza y el vino, la extracción de sustancias de las plantas para usarlas como medicinas o perfumes y la transformación de las grasas en jabón.

A base de realizar experimentos y registrar sus resultados los alquimistas establecieron los cimientos de la química moderna. El punto de inflexión se produjo con la obra de 1661, The Sceptical Chymist (El químico escéptico) de Robert Boyle, donde separó claramente la química de la alquimia, y en adelante la química aplicaría el método científico en sus experimentos. Se considera que la química alcanzó el rango de ciencia de pleno derecho con las investigaciones de Antoine Lavoisier, en las que basó su ley de conservación de la materia, entre otros avances que asentaron los pilares fundamentales de la química. A partir del siglo XVIII la química adquiere definitivamente las características de una ciencia experimental moderna. Se desarrollaron métodos de medición más precisos que permitieron un mejor conocimiento de los fenómenos y se desterraron creencias no demostradas. La historia de la química se entrelaza con la historia de la física, como en la teoría atómica, y en particular con la termodinámica desde sus inicios con el propio Lavoisier, y especialmente a través de la obra de Willard Gibbs.
1.1. Introducción a la historia de la química, los tiempos de la magia y el arte.
1.2. La Química y su historia
2. Definiciones actuales
La química es la ciencia que estudia la composición, estructura y propiedades de la materia, así como los cambios que esta experimenta durante las reacciones químicas y su relación con la energía. Linus Pauling la define como la ciencia que estudia las sustancias, su estructura (tipos y formas de acomodo de los átomos), sus propiedades y las reacciones que las transforman en otras sustancias en referencia con el tiempo. La química se ocupa principalmente de las agrupaciones supraatómicas, como son los gases, las moléculas, los cristales y los metales, estudiando su composición, propiedades estadísticas, transformaciones y reacciones. La química también incluye la comprensión de las propiedades e interacciones de la materia a escala atómica.
La mayoría de los procesos químicos se pueden estudiar directamente en el laboratorio, usando una serie de técnicas a menudo bien establecidas, tanto de manipulación de materiales como de comprensión de los procesos subyacentes. Una aproximación alternativa es la proporcionada por las técnicas de modelado molecular, que extraen conclusiones de modelos computacionales. La química es llamada a menudo «ciencia central», por su papel de conexión con las otras ciencias naturales.
Algunas definiciones:
3. Los fenómenos químicos en nuestro entorno
Los fenómenos químicos ocurren constantemente a nuestro alrededor, prácticamente en todas las cosas e incluso en cada uno de nosotros mismos. Aunque pocas veces somos conscientes de este tipo de fenómenos, en realidad son muy interesantes y conocerlos nos hace ver las cosas de otra manera.
Para aprender a reconocer los fenómenos químicos, hoy voy a enseñarte lo más básico detrás de ellos. Además, veremos 10 ejemplos de fenómenos químicos que ocurren a diario y que pasan casi que desapercibidos.
Comencemos con lo esencial preguntándonos qué es un fenómeno químico. En química, se le llama fenómeno químico a cualquier tipo de fenómeno natural que implique la química, por ejemplo un cambio molecular.
Son aquellos sucesos que se pueden observar y también medir en los que las sustancias que intervienen modifican su composición química luego de combinarse unas con otras. Se caracterizan por el hecho de que al ocurrir ya no vuelven a su estado original: son irreversibles.
Tampoco hay conservación de la sustancia, la materia se transforma y se manifiesta la energía en un cambio que no se puede apreciar a simple vista. Son aquellos que ocurren con la transformación de la materia y la sustancia original no se conserva.
Si tenemos en cuenta el concepto de reacción química, según el cual ocurre cuando al menos una sustancia cambia, entonces podemos decir que una reacción química es un fenómeno químico. Cada cambio que ocurre en una reacción química se puede expresar mediante una una ecuación química utilizando los símbolos y las fórmulas químicas de cada sustancia implicada y existen 6 categorías en la que la reacción se puede clasificar, brevemente detalladas a continuación.
- Combustión: cuando el oxígeno se combina con otro compuesto formando agua y dióxido de carbono. Estas son reacciones exotérmicas y producen calor.
- Síntesis: cuando dos o más compuestos simples se combinan para formar uno más complejo.
- Descomposición: una molécula compleja se descompone para hacer más simples (es lo contrario de una reacción de síntesis).
- Desplazamiento individual: cuando un elemento cambia su lugar con otro elemento en un compuesto.
- Desplazamiento doble: cuando los aniones y cationes de dos moléculas distintas cambian de lugar, formando dos compuestos totalmente distintos.
- Ácido-base: es un tipo de reacción de desplazamiento doble especial que tiene lugar cuando un ácido y una base reaccionan entre sí. El ion H + en el ácido reacciona con el ion OH- en la base. Esto provoca la formación de agua.
Ejemplos de fenómenos químicos
- Encender un fósforo
- Combustión del papel
- Dilución de un medicamento en agua
- La formación del petróleo
- Oxidación de un clavo
- Digestión de los alimentos
- El vino que se convierte en vinagre
- La leche convertida en cuajo
- La reacción de dos sustancias (como la reacción de oxígeno e hidrógeno para formar H2O)
- La grabación del negativo de una fotografía
3.1. Cambios físicos y cambios químicos
4. Ramas de la química
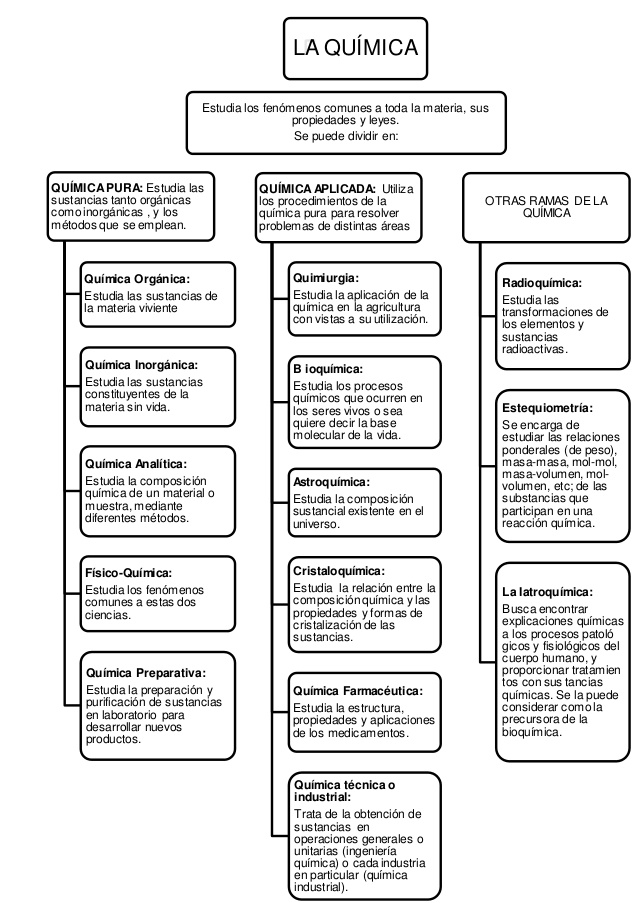
Química General: Estudia los fenómenos comunes a toda la materia, sus propiedades y leyes. Ciencia experimental que se ocupa de las transformaciones de unas sustancias en otras sin que se alteren los elementos que las integran. La química moderna introduce en el ambiente moléculas complejas que antes no existían en la naturaleza. La rama más peligrosa es la producción de la química orgánica. La otra que ataca el medio es la química del azufre; sólo tiene los anhídridos y los ácidos sulfurosos y sulfúricos, los sulfuros y los sulfatos. Pero la química orgánica -a partir de la química del carbón y la petroquímica- logran enlazar el carbono, el hidrógeno y el oxígeno en una variedad ilimitada de estructuras. Fabrica moléculas nuevas que nunca han existido atacando la ley biológica de que siempre hay una enzima que destruye cada molécula que se construye.
El mayor éxito y el más peligroso de la química orgánica es la invención de los hidrocarburos clorados: El PCB, el PVC, DDT, Ticlorofenol que desprende la Dioxina, altamente tóxica y quede lugar a mutaciones. Todos con aplicaciones diversas, pero igualmente tóxicos.
Esta disciplina tan amplia se subdivide en 2 ramas de la química bien definidas: la química pura y la química aplicada. Cada una de ellas genera un sin número de sub-divisiones más específicas.
Química pura Estudia las sustancias tanto orgánicas como inorgánicas , y los métodos que se emplean para ello
Química aplicada Utiliza los procedimientos de la química pura para resolver problemas de distintas áreas
Química Orgánica: Estudia las sustancias de la materia viviente. Justus von Liebig (1803-1873) fue uno de los principales artífices del desarrollo de la química orgánica del siglo XIX. También estudió con Liebig el español Ramón Torres Muñoz de Luna (1822-1890) que tradujo al castellano alguna obras del químico alemán.
Una de las contribuciones de Liebig en el campo de la química orgánica fue el desarrolló de métodos de análisis más precisos y seguros. El grabado inferior, procedente del Tratado elemental de química general y descriptiva de Santiago Bonilla publicado a finales de siglo, muestra un aparato basado en el método de Liebig para determinar carbono e hidrógeno en sustancias orgánicas. El procedimiento está basado en la propiedad del óxido cúprico de oxidar las sustancias orgánicas que con él se calientan para transformarlas en dióxido de carbono y agua.
Otra contribución fundamental en el desarrollo de la química orgánica de este período fue la introducción por parte de Berzelius del concepto de "isomerismo" y los estudios cristalográficos de Louis Pasteur (1822-1895) sobre los isómeros ópticos del ácido tartárico (ácido 2,3-dihidroxibutanodioico). El "tártaro" (un tartrato ácido de potasio) era bien conocido por los vinicultores como un sólido que se separaba del vino durante la fermentación. A principios del siglo XIX, se encontró un tipo especial de este ácido que tenía un comportamiento algo diferente del ácido tartárico conocido hasta la fecha, que Gay-Lussac denominó "ácido racémico", del latín racemus (uva). Posteriores análisis mostraron que el ácido tartárico giraba el plano de polarización de la luz polarizada hacia la derecha (actividad óptica dextrógira), mientras que el ácido racémico era ópticamente inactivo. En 1848, Louis Pasteur separó los dos tipos de cristales que formaban el ácido racémico y comprobó que eran imágenes especulares uno de otro.
Química Inorgánica: Estudia las sustancias constituyentes de la materia sin vida.
El tratado de química del sueco Jöns Jacob Berzelius (1779-1848) fue una de las obras de referencia más importantes para los químicos de la primera mitad del siglo XIX. Además de sus importantes contribuciones al desarrollo de la química inorgánica, Berzelius es recordado por haber introducido las modernas fórmulas químicas. Se expone el primer volumen de la traducción castellana de los Doctores D. Rafael Sáez y Palacios y D. Carlos Ferrari y Scardini que apareció en Madrid en 15 volúmenes entre 1845 y 1852.
Química Analítica: El desarrollo de la química analítica a mediados del siglo XIX aparece con las obras de Heinrich Rose (1795-1864) y Karl Remegius Fresenius (1818-1897). Heinrich Rose fue profesor de química en la Universidad de Berlín, desde donde realizó numerosas contribuciones a la química, entre ellas el descubrimiento del niobio. El proceso de análisis de Rose se abría con el uso del ácido clorhídrico que permitía identificar la plata, mercurio y plomo. La traducción castellana de la obra de Rose que aquí exponemos fue realizada por el médico catalán Pere Mata i Fontanet (1811-1877), discípulo de Mateu Orfila que realizó una notable producción en el campo de la toxicología. En 1841 publicó su Anleitung zur qualitativen chemischen Analyse cuya traducción castellana aparecida en 1853 se expone. También publicó la primera revista dedicada a la química analítica: Zeitschrift für analytische Chemie que comenzó a aparecer en 1862. Las traducciones al castellano más completas de la obra de Fresenius fueron publicadas en Valencia gracias a la labor del médico Vicente Peset y Cervera (1855-1945).
Físico-Química: Estudia los fenómenos comunes a estas dos ciencias. La química física no se constituyó como especialidad independiente hasta finales del siglo pasado y principios del actual. A pesar de ello, durante todo el siglo XIX se realizaron notables aportaciones a algunos de los campos que habitualmente suelen reunirse bajo la química física como la termoquímica, la electroquímica o la cinética química.
Química Preparativa: Estudia la preparación y purificación de sustancias en laboratorio para desarrollar nuevos productos.
Las ramas de la Química Aplicada:Quimiurgia: Estudia la aplicación de la química en la agricultura con vistas a su utilización como materia prima en otras industrias; las mieles, por ejemplo obtenidas de los azúcares de remolacha pueden utilizarse como base de alcohol, las tusas de maíz para combustible, el maní para lanas artificiales (Ardil), la grasa de la lana de los carneros para unturas y cosméticos y el furfural para una amplia variedad de productos.
Bioquímica: Estudia los procesos químicos que ocurren en los seres vivos o sea quiere decir la base molecular de la vida. En los procesos vitales interaccionan un gran número de substancias de alto peso molecular o macromoléculas con compuestos de menor tamaño, dando por resultado un número muy grande de reacciones coordinadas que producen la energía que necesita la célula para vivir, la síntesis de todos los componentes de los organismos vivos y la reproducción celular. Al conjunto de reacciones que suceden dentro de los seres vivos se le llama metabolismo. Actualmente se conoce a detalle la estructura tridimensional de las macromoléculas de mayor importancia biológica, los ácidos nucleicos y las proteínas, lo que ha permitido entender a nivel molecular sus funciones biológicas. Gracias al conocimiento de la estructura de los ácidos nucleicos, se esclarecieron los mecanismos de transmisión de la información genética de generación a generación, y también los mecanismos de expresión de esa información, la cual determina las propiedades y funciones de las células, los tejidos, los órganos y los organismos completos.
Astroquímica: Estudia la composición sustancial existente en el universo. Es la ciencia que se ocupa de la composición química del Sol y de los planetas, de las estrellas y de la materia difusa interplanetaria o, más en general, interestelar.
La astroquímica estudia el comportamiento de los diversos tipos de moléculas y de iones libres en la atmósfera de los cuerpos celestes, e investiga, además, la formación del denominado polvo cósmico y la abundancia relativa de los elementos químicos en el Universo.
Para ello se vale del análisis espectroscópico de la radiación electromagnética emitida o absorbida por los cuerpos celestes.
Los astroquímicos cuentan fundamentalmente con las técnicas de la radioastronomía y espectroscopia para realizar sus análisis de la materia interestelar, las estrellas y las galaxias. La mayor parte del trabajo teórico en cosmología está dedicado a rastrear la evolución de los elementos químicos desde el primitivo Big Bang o Gran Explosión hasta la muerte de las estrellas.
Cristaloquímica: Sobre la relación entre la composición química y las propiedades y formas de cristalización de las sustancias
Química Farmacéutica: Estudia la estructura, propiedades y aplicaciones de los medicamentos.
Química técnica o industrial: Trata de la obtención de sustancias en operaciones generales o unitarias (ingeniería química) o cada industria en particular (química industrial).
Otras Ramas de la Química
Radioquímica: Estudia las transformaciones de los elementos y sustancias radioactivas. Tambien estudia las propiedades de los radioisótopos, los métodos para su obtención y purificación, su uso en la investigación química y los efectos químicos de las transformaciones nucleares.
Estequiometría: Es la rama de la química que se encarga de estudiar las relaciones ponderales (de peso), masa-masa, mol-mol, masa-volumen, mol-volumen... de las substancias que participan en una reacción química. Para que dicha ley se cumpla las ecuaciones químicas deben estar correctamente balanceadas; para ello existen tres diferentes métodos de balanceos de ecuaciones, de balanceos de ecuaciones, son tanteo, algebraico, redox.
Estoicheión = elemento o sustancia, Metría = medición. Es la masa de una microscópica molécula de cualquier compuesto, y se expresa en unidades de masa (mas.)
La Iatroquímica: El sistema iatroquímico, vigente durante la segunda mitad del siglo XVII, asumió las interpretaciones paracelsistas, pero eliminando sus elementos panvitalistas y metafísicos, que sustituyó por el mecanicismo, el atomismo y el método científico inductivo. Palestra pharmacéutica chymico-galénica (1706) del iatroquímico español Félix Palacios, abierta por una de sus láminas sobre instrumentos de laboratorio y reproducción de su tabla de símbolos.
5. Método científico
Método científico
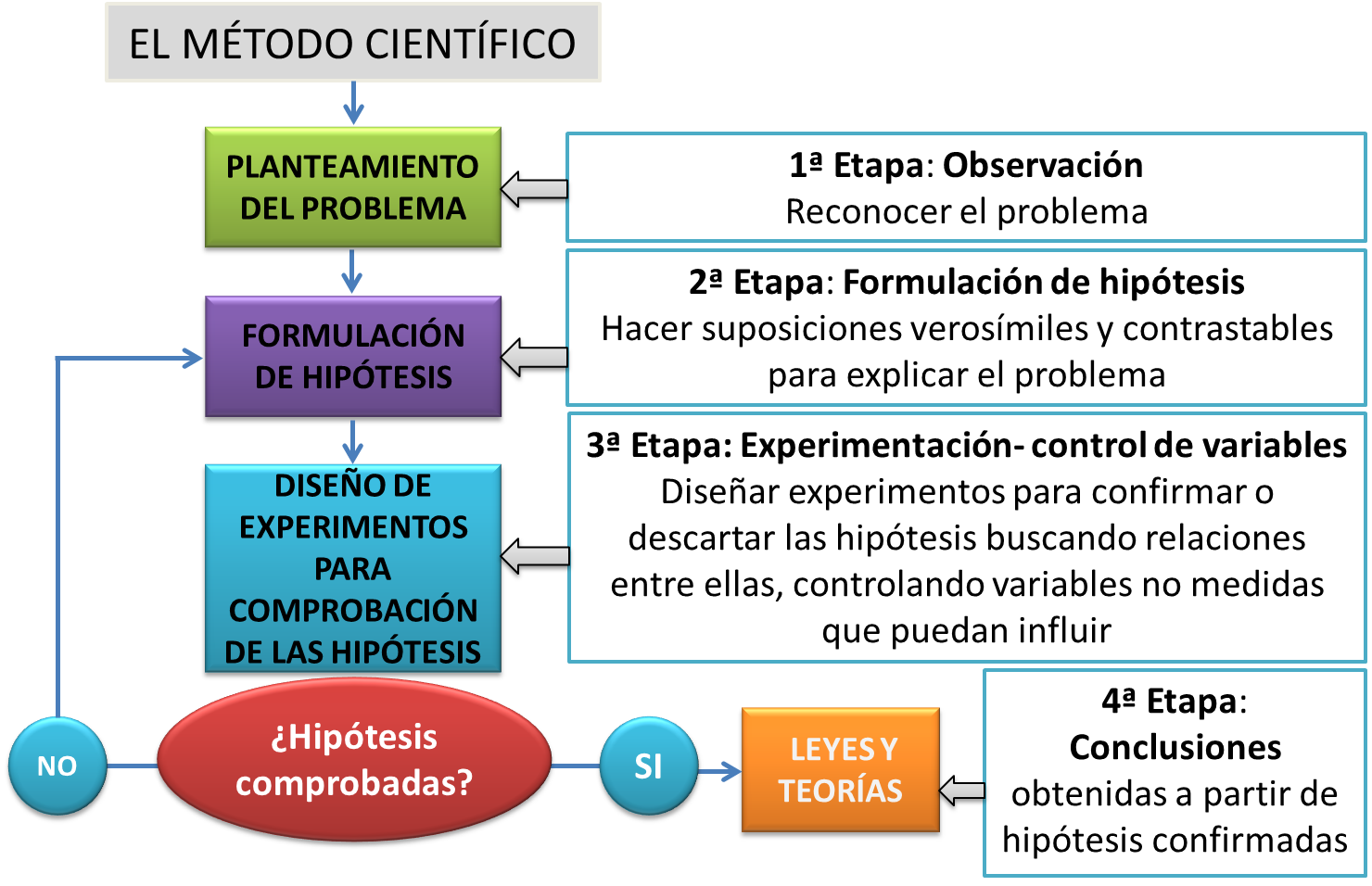
La palabra método se deriva de los vocablos “metá” que significa a lo largo y “odos” que significa camino, con esto podemos entender que es el camino por el cual se llega a cierto resultado en la actividad científica.
El método científico se ha definido como el conjunto de etapas que señalan el procedimiento para llevar a cabo una investigación cuyos resultados sean aceptados como válidos por la comunidad científica.
El método científico se atiende a reglas ya establecidas que son una serie de etapas que se deben seguir para llegar al resultado que se quiere obtener. Las etapas del método científico son:
- Definir el problema u objeto de la investigación
- Plantear la hipótesis
- Elaborar el diseño experimental, modelo o prototipo
- Realizar experimentos, cálculos o pruebas
- Analizar los resultados
- En caso de ser necesario reajustar el experimento, modelo o prototipo y regresar a la etapa 4
- Obtener conclusiones
- Contrastar las conclusiones con las predicciones
- Sugerencias de trabajos futuros
- Elaboración de un informe escrito
El método científico se basa en la realidad ya que su fuente de información y respuestas son los hechos, aun cuando parte de los hechos, trata de llegar más allá de ellos, mediante la elaboración de abstracciones y generalizaciones. Es auto correctivo ya que si no llega al resultado se cambian por nuevos aportes o técnicas para poder llegar al resultado.
El método científico es racional porque se funda en la razón, lo cual significa que parte de conceptos, juicios y razonamientos por lo tanto, el método científico no puede tener su origen en las apariencias producidas por las sensaciones, por las creencias o preferencias personales. También es racional porque las ideas producidas se combinan de acuerdo a ciertas reglas lógicas, con el propósito de producir nuevas ideas.
El método científico se usa desde hace mucho tiempo y con este método se han descubierto grandes avances durante la historia en todas las ciencias, con él se han creado leyes que usamos hoy en día.
El Método Científico :
El metodo cientifico es el proceso de experimentación que es usado para explorar observaciones y responder preguntas. Los científicos usan este método para buscar la causa y el efecto de las relaciones en la naturaleza. En otras palabras, ellos diseñan un experimento que muestra los cambios de un objeto hacia otro con información que respalda estas acciones.
Este proceso es muy eficaz para descubrir si una teoría es verídica o no, gracias a sus múltiples y sencillos pasos a seguir.
Todo comienza con una simple pregunta o teoría. Esta se puede basar en cualquier pensamiento o duda que una persona pueda tener.
El siguiente paso es un poco más complejo. una vez que una persona tiene su teoría o su pregunta, Esta tiene que indagar y absorber toda la información posible sobre ese tema. Lo ideal es descubrir el ¨¿Qué? ¿Cómo? ¿Cuándo? ¿Dónde? ¿Porqué?¨, estas cinco sencillas preguntas le abrirán las puertas a la persona interesada a todo tipo de información sobre el tema deseado.
Una vez que el proceso de investigación a terminado, es hora de poner toda esa sabiduría en prueba. Una hipótesis debe ser creada durante este proceso. La hipótesis es un posible resultado o solución a un problema, y está basado en la información previamente obtenida. La hipótesis puede estar mal, ya que es una simple estimación del resultado final.
Ahora, es el momento de poner esa hipótesis a prueba. Dependiendo de la pregunta o teoría original, el experimento puede variar, puede ser una encuesta, una reacción química, etc. Una vez que el experimento está listo, hay que colocar los resultados en una tabla, gráfica o de manera que se vean de una manera organizada.
Una vez acabada esta tarea, hay que regresar a la hipótesis y compararla con el resultado final. Una conclusión debe sellar este proceso explicando si la hipótesis fue correspondiente al resultado final, también puede incluir un resumen de todo este proceso, las fallas, algún cambio que se pudiera hacer a futuro, etc. El método científico es perfecto para encontrar la respuesta a un problema, ya que si el resultado no es el esperado, se puede cambiar el proceso y ver que sucede.

5.1. El método científico
5.2. ¿QUÉ ES EL MÉTODO CIENTÍFICO? | Ciencias de la Ciencia
6. Compuestos químicos
Los Compuesto Químicos son sustancias que están formadas por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos iniciales. Al juntar los 2 elementos iniciales se forma una reacción química que da lugar a otra sustancia diferente. Fíjate en los dos ejemplos siguientes:
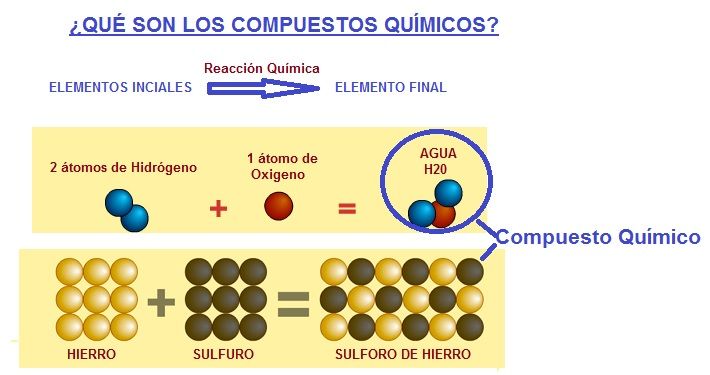
Si el compuesto está formado solo por dos tipos de átomos diferentes, como por ejemplo el agua que está formada por hidrógeno H y oxigeno O, se llama Compuesto Binario.
Pero para entender mucho mejor todo esto de los compuestos químicos empecemos por el principio, definiendo que es un elemento químico, base del compuesto, ya que como vimos anteriormente para su formación se necesitan 2 elementos como mínimo.
Un elemento químico es aquella materia que está formada por átomos todos iguales. Por ejemplo, un trozo de hierro puro al verlo al microscopio, solo veremos átomos de Fe (hierro), eso quiere decir que es una sustancia pura y además simple, o lo que es lo mismo que el Fe es un elemento.
Existen 144 elementos conocidos por el hombre en el universo, agrupados en la tabla periódica de los elementos.
Como se Forman Los Compuestos Químicos
Los compuestos químicos están formados por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos (reacción química, que se puede conseguir con un reactor químico).
OJO puede darse el caso que los dos elementos no reaccionen, en este caso, si no hubieran reaccionado formarían una mezcla (homogénea o heterogénea) y NO un compuesto químico.
Los compuestos químicos tienen una proporción fija. Si los elementos iniciales fueran los mismos, pero cambiáramos la proporción (cantidad) de cada uno de ellos, el compuesto ya no sería el mismo porque el compuesto tendría propiedades diferentes.
Como los elementos químicos están formados por átomos, los compuestos químicos tienen átomos agrupados de los elementos iniciales que lo formaron. Esta agrupación es lo que se llama molécula. Las moléculas se forman en la reacción de los elementos para formar el compuesto.
Por ejemplo si hacemos que reaccionen 2 átomos de hidrógeno con 1 de oxigeno, obtendríamos un compuesto químico llamado agua = H2O.

También podríamos separar (no siempre) los átomos que forman un compuesto químico, pero en este caso solo se podrían separar con una reacción química, nunca física, ya que la sustancia inicial (el compuesto químico) ya no sería igual a la final, que en este caso serían dos sustancias diferentes = 2 elementos o dos átomos que formaban el compuesto.
Según lo dicho hasta aquí podemos definir de una manera más científica, más química, los compuestos químicos.
"Un compuesto químico es una sustancia formadas por moléculas todas iguales, que solo se pueden separar en otras más simples por reacciones químicas".
Los principales compuestos químicos que existen en la actualidad son:
6.1. Compuestos químicos
7. Mezcla y combinación
MEZCLAS
Al hablar de una mezcla diremos que es la unión de dos o más sustancias o compuestos, en la que cada una mantiene sus propiedades; y luego pueden separarse fácilmente por acción mecánica, obteniéndose las sustancias primarias sin ninguna alteración.
CARACTERISTICAS DE LAS MEZCLAS
Para que se pueda llevar a cabo una mezcla es necesario que se cumplan ciertas características:
Que las sustancias que intervengan no pierdan sus propiedades. Ejemplo: al mezclar, en un vaso con agua, una cucharada de sal, el agua sigue siendo líquida y la sal no perdió su sabor salado.
La cantidad de sustancias que forman una mezcla puede ser variable. Ejemplo: Si al vaso de agua se le agrega una o tres cucharadas de sal.
Cuando se unen las sustancias para formar la mezcla no hay desprendimiento ni absorción de energía eléctrica, calorífica o luminosa. Ejemplo: al mezclar el agua con la sal no hay desprendimiento de electricidad, calor o luz.
Las sustancias que intervienen pueden separarse por acciones mecánicas o físicas. Ejemplo: mediante la evaporación del agua por la acción del calor, podemos volver a obtener la sal.
TIPOS DE MEZCLA
MEZCLAS HOMÓGENEAS

Son en las que las sustancias que intervienen no se pueden diferenciar a simple vista. Ejemplo: la sangre, solo al verla no podemos diferenciar el plasma de los elementos figurados. Otros ejemplos de mezcla homogéneas: la leche, el aire, el agua.
MEZCLAS HETERÓGENEAS

Son las mezclas en las que las sustancias que intervienen se pueden diferenciar a simple vista. Ejemplo: el agua con el aceite, es un ejemplo muy claro de mezcla heterogénea. Como tú sabes el aceite es una sustancia oleosa, que nunca pueden unirse con el agua ya que por ser más liviano flota sobre el agua. Otros ejemplos de mezclas heterogéneas: las limaduras de hierro con agua, el arroz con el agua.
Según el estado de los componentes de la mezcla, éstas pueden ser:
Sólido – sólido Ejemplo: Arroz y arena
Sólido – líquido Ejemplo: Piedras y agua
Líquido – líquido Ejemplo: Agua y jugo de limón
Líquido – Gas Ejemplo: Agua y gas carbónico
Gas – Gas Ejemplo: El aire que respiramos.
COMBINACIÓN
Es la unión íntima de dos o más sustancias que al juntarse se transforman formando una tercera sustancia cuyas propiedades son diferentes y aun contrarias a las de sus componentes. Toda combinación sufre un fenómeno químico.
Ej.:Si combinamos 4 grs. de azufre con 7 grs. de hierro y lo sometemos a la acción de alta temperatura, estas sustancias se combinan con desprendimiento de calor formando un compuesto llamado sulfuro ferroso, de color gris casi negro.
Si observamos esta sustancia con una lente, ya no se distinguirá el hierro ni el azufre sino partículas de color y aspecto uniforme.
Si le acercamos un imán, veremos que ya no atrae al hierro porque ha perdido sus propiedades magnéticas.
Si dejamos caer la sustancia en un vaso de agua, veremos que íntegra se va al fondo.
Todo lo dicho nos demuestra que en la combinación de hierro y azufre han perdido sus propiedades cada uno de sus componentes por haber sufrido una transformación tan íntima que ha dado lugar a la formación de una nueva sustancia.
Como otros ejemplos de combinación podemos indicar la del azufre con el zinc, que da el sulfuro de zinc; la del sodio con el cloro, que da el cloruro de sodio o sal común.
8. Fórmulas químicas
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura química. Ejemplo: La fórmula general de los silanos es SinHm.
A veces, los miembros de una familia química se diferencian entre sí por una unidad constante, generalmente un átomo de carbono adicional en una cadena carbonada.
Existen varios tipos de fórmulas químicas:
Fórmula molecular
La fórmula molecular indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada elemento de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.
La fórmula Semidesarrollada es similar a la anterior, pero indicando los enlaces entre los distintos grupos de átomos para resaltar, sobre todo, los grupos funcionales que aparecen en la molécula. Es muy usada en química orgánica, donde se puede visualizar fácilmente la estructura de la cadena carbonada y los diferentes sustituyentes. Así, la glucosa tendría la siguiente fórmula semidesarrollada:
Fórmula desarrollada
La fórmula desarrollada es más compleja que la fórmula semidesarrollada. Indica todos los enlaces representados sobre un plano cartesiano, que permite observar ciertos detalles de la estructura que resultan de gran interés.
Fórmula estructural
La fórmula estructural es similar a las anteriores, pero señalando la geometría espacial de la molécula mediante la indicación de distancias, ángulos o el empleo de perspectivas en diagramas bi o tridimensionales.
9. Reacción y ecuación química
Reacción química y ecuaciones químicas
Una Reacción química es un proceso en el cual una sustancia (o sustancias) desaparece para formar una o más sustancias nuevas.
Las ecuaciones químicas son el modo de representar a las reacciones químicas.
Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H20). La ecuación química para esta reacción se escribe:
![]()
El "+" se lee como "reacciona con"
La flecha significa "produce".
Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos.
A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos.
Los números al lado de las formulas son los coeficientes (el coeficiente 1 se omite).