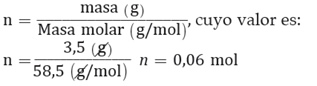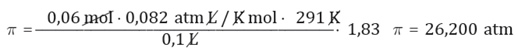DISOLUCIONES, PROPIEDADES COLIGATIVAS Y SU USO COTIDIANO EN LA COMUNIDAD
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 5° - Ciencias Naturales: Química |
| Libro: | DISOLUCIONES, PROPIEDADES COLIGATIVAS Y SU USO COTIDIANO EN LA COMUNIDAD |
| Impreso por: | Invitado |
| Fecha: | miércoles, 4 de diciembre de 2024, 19:14 |
1. Componentes de una disolución y preparación de diferentes tipos de disoluciones
DISOLUCIONES
Las disoluciones son mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente es la sustancia que está en igual estado físico que la disolución. Cuando hay una ruptura de enlaces hay una reacción química y un cambio energético.
El soluto puede ser un gas, un líquido o un sólido, y el disolvente puede ser también un gas, un líquido o un sólido. El agua con gas es un ejemplo de un gas (dióxido de carbono) disuelto en un líquido (agua). Las mezclas de gases, como ocurre en la atmósfera, son disoluciones.

Las disoluciones verdaderas se diferencian de las disoluciones coloidales y de las suspensiones en que las partículas del soluto son de tamaño molecular, y se encuentran dispersas entre las moléculas del disolvente. Observadas a través del microscopio, las disoluciones aparecen homogéneas y el soluto no puede separarse por filtración. Las sales, ácidos y bases se ionizan al disolverse en agua. Algunos metales son solubles en otros en estado líquido y solidifican manteniendo la mezcla de átomos. Si en dicha mezcla los dos metales pueden solidificar en cualquier proporción, se trata de una disolución sólida llamada aleación.
Las disoluciones se caracterizan por tener una fase homogénea, es decir, tiene las mismas características en todos sus puntos, o lo que es lo mismo: el aspecto, sabor, color, etc. son siempre los mismos. Si una disolución está turbia ya no es una disolución; y existen disoluciones de todos los estados físicos en todos los estados físicos en todos los estados físicos.
Las disoluciones se pueden clasificar según su concentración en:
Diluidas: En estas, hay muy poca cantidad de soluto, el disolvente puede seguir admitiendo más soluto.
Concentradas: En ellas hay bastantante cantidad de soluto disuelto, pero el disolvente todavía puede seguir admitiendo más soluto.
Saturadas: Son aquellas que a una temperatura determinada no pueden seguir admitiendo más soluto. Si la temperatura aumenta, la capacidad para admitir más soluto aumenta.
Sobresaturadas: Son aquellas que estando saturadas a una temperatura determinada, se aumenta esta para poder echar más soluto, y se vuelve a bajar con cuidado para que no precipite. Si se les añade más soluto o se mueve bruscamente, precipita.
Existen distintas formas de expresar la concentración de una disolución, pero las dos más utilizadas son: gramos por litro (g/l) y molaridad (M).
Los gramos por litro indican la masa de soluto, expresada en gramos, contenida en un determinado volumen de disolución, expresado en litros. Así, una disolución de cloruro de sodio con una concentración de 40 g/l contiene 40 g de cloruro de sodio en un litro de disolución.
La molaridad se define como la cantidad de sustancia de soluto, expresada en moles, contenida en un cierto volumen de disolución, expresado en litros, es decir: M = n/V. El número de moles de soluto equivale al cociente entre la masa de soluto y la masa de un mol (masa molar) de soluto. Por ejemplo, para conocer la molaridad de una disolución que se ha preparado disolviendo 70 g de cloruro de sodio (NaCl) hasta obtener 2 litros de disolución, hay que calcular el número de moles de NaCl; como la masa molar del cloruro de sodio es la suma de las masas atómicas de sus elementos, es decir,
23 + 35,5 = 58,5 g/mol, el número de moles será 70/58,5 = 1,2 y, por tanto, M = 1,2/2= 0,6 M (0,6 molar).
Disoluciones, Tipos de mezcla https://www.uv.es/~gomezc/BQMA/Tema6_presentacion.pdf
1.1. ¿Qué es una disolución? ¿Cuáles son los tipos de desilución? Tipos de desiluciones
1.2. Disolución/solución: soluto y disolvente (o solvente)
2. Uso de unidades de concentración químicas y físicas en la comunidad
Concentración Química: Expresión, Unidades, Molalidad
La concentración química es la medida numérica de la cantidad relativa de soluto en una solución. Esta medida expresa una relación del soluto respecto a una cantidad o volumen del solvente o de la solución en unidades de concentración. El término «concentración» se vincula con la cantidad de soluto presente: una solución estará más concentrada mientras más soluto posea.
Estas unidades pueden ser físicas cuando se toma en cuenta las magnitudes de masa y/o volumen de los componentes de la solución o químicas, cuando la concentración del soluto viene expresada en función de sus moles o equivalentes, tomando como referencia el número de Avogadro.

Así, mediante el uso de los pesos moleculares u atómicos, y el número de Avogadro, es posible convertir las unidades físicas en químicas al momento de expresar la concentración de determinado soluto. Por lo tanto, todas las unidades pueden convertirse para una misma solución.
Soluciones diluidas y concentradas
¿Cómo puede advertirse si una concentración está muy diluida o concentrada? A primera vista por la manifestación de cualquiera de sus propiedades organolépticas o químicas; es decir, aquellas que perciben los sentidos o que pueden medirse.
En la imagen superior se muestra una dilución de una concentración de dicromato de potasio (K2Cr2O7), la cual exhibe un color anaranjado. De izquierda a derecha puede apreciarse cómo el color disminuye su intensidad a medida que se diluye la concentración, agregando más solvente.
Esta dilución permite obtener de esta manera una concentración diluida a partir de una concentrada. El color (y otras propiedades “ocultas” en su seno anaranjado) cambia del mismo modo como lo hace su concentración, ya sea con las unidades físicas o químicas.
Pero, ¿cuáles son las unidades químicas de concentración? Entre ellas se encuentran la molaridad o concentración molar de una solución, la cual relaciona los moles de soluto por el volumen total de la solución en litros.
También se tiene la molalidad o denominada igualmente como concentración molal, la cual se refiere a los moles de soluto pero que se contienen en una cantidad estandarizada del solvente o disolvente que es exactamente un kilogramo.
Este disolvente puede ser puro o si la solución contiene más de un disolvente la molalidad será los moles del soluto por kilogramo de la mezcla de disolventes.
Y la tercera unidad de concentración química es la normalidad o concentración normal de una solución que expresa el número de equivalentes químicos del soluto por litro de la solución.
La unidad en la que se expresa la normalidad es en equivalentes por litro (Eq/L) y en medicina la concentración de los electrolitos del suero humano se expresa en miliequivalentes por litro (mEq/L).
Formas de expresar la concentración
La concentración de una solución se puede denotar de tres maneras principales, aun cuando estas tengan una gran variedad de términos y unidades en sí, que puedan utilizarse para expresar la medida de este valor: la descripción cualitativa, la notación cuantitativa y la clasificación en términos de solubilidad.
Dependiendo del lenguaje y contexto en el cual se está trabajando, se escogerá una de las tres maneras para expresar la concentración de una mezcla.
Descripción cualitativa
Utilizada principalmente en lenguaje informal y no-técnico, la descripción cualitativa de la concentración de una mezcla se expresa en forma de adjetivos, los cuales indican de manera generalizada el nivel de concentración que posee una solución.
De esta manera, el nivel mínimo de concentración según la descripción cualitativa es el de una solución «diluida», y el máximo es el de «concentrada».
Se habla de disoluciones diluidas cuando una solución posee una proporción muy baja de soluto en función del volumen total de la solución. Si se desea diluir una solución, se debe agregar una mayor cantidad de solvente o buscar la manera de reducir el soluto.
Ahora, se habla de soluciones concentradas cuando estas tienen una alta proporción de soluto en función del volumen total de solución. Para concentrar una solución se debe agregar más soluto, o bien reducir la cantidad de solvente.
En este sentido, se hace llamar descripción cualitativa a esta clasificación, no solo porque carece de mediciones matemáticas sino por su calidad empírica (se puede atribuir a rasgos visuales, olores y sabores, sin necesidad de pruebas científicas).
Clasificación por solubilidad
La solubilidad de una concentración denota la capacidad máxima de soluto que posee una disolución, dependiendo de condiciones como temperatura, presión y las sustancias que están disueltas o en suspensión.
Las soluciones pueden clasificarse en tres tipos según su nivel de soluto disuelto al momento de la medición: disoluciones insaturadas, saturadas y sobresaturadas.
– Las soluciones insaturadas son aquellas que contienen una cantidad menor de soluto de la que puede disolver la solución. En este caso, la solución no ha llegado a su concentración máxima.
– Las soluciones saturadas son aquellas en las que se ha disuelto la máxima cantidad de soluto posible en el solvente a una temperatura específica. En este caso existe un equilibrio entre ambas sustancias y la solución no puede aceptar más soluto (ya que pasará a precipitarse).
– Las soluciones sobresaturadas tienen más soluto del que la solución aceptaría en condiciones de equilibrio. Esto se logra al calentar una solución saturada, añadiendo más soluto del normal. Una vez fría no precipitará el soluto automáticamente, pero cualquier perturbación puede causar este efecto por su inestabilidad.
Notación cuantitativa
Al momento de estudiar una solución para emplearse en el ámbito técnico o científico, se requiere de una precisión medida y expresada en unidades, las cuales describen la concentración según sus valores exactos de masa y/o volumen.
Es por esto que existe una serie de unidades utilizadas para expresar la concentración de una solución en su notación cuantitativa, las cuales se dividen en físicas y químicas, y que a su vez poseen sus propias subdivisiones.
Las unidades de concentraciones físicas son aquellas de «concentración relativa», las cuales se expresan en función de porcentajes. Existen tres maneras de expresar las concentraciones porcentuales: porcentajes de masa, porcentajes en volumen y porcentajes de masa-volumen.
En cambio, las unidades de concentraciones químicas se basan en las cantidades molares, equivalentes por gramo, partes por millón y otras características del soluto con respecto a la solución.
Estas unidades son las más comunes por su alta precisión a la hora de medir concentraciones, y por esto suelen ser las que se desea conocer para trabajar con disoluciones químicas.
Unidades de concentración
Como se ha descrito en las secciones previas, al momento de caracterizar cuantitativamente la concentración de una solución, los cálculos deben regirse por las unidades existentes para tal fin.
Asimismo, las unidades de concentración se dividen en aquellas de concentración relativa, las de concentraciones diluidas, aquellas basadas en moles, y otras adicionales.
Unidades de concentración relativa
Las concentraciones relativas son aquellas expresadas en porcentajes, como se nombró en la sección anterior. Estas unidades se dividen en el porcentaje masa-masa, el porcentaje volumen-volumen y el porcentaje masa-volumen, y se calculan de la siguiente manera:
– % masa = masa de soluto (g) / masa de disolución total (g) x 100
– % volumen = volumen de soluto (ml) / volumen de disolución total (ml) x 100
– % masa/volumen = masa de soluto (g) / volumen de disolución total (ml) x 100
En este caso, para calcular la masa o volumen de disolución total se debe sumar la masa o volumen del soluto con el del solvente.
Unidades de concentración diluida
Las unidades de concentración diluida son aquellas que se utilizan para expresar aquellas concentraciones muy pequeñas que se hallan en forma de trazas dentro de una solución diluida; el uso más común que se le presenta a estas unidades es para hallar trazas de un gas disuelto en otro, como lo agentes que contaminan el aire.
Estas unidades se indican en forma de partes por millón (ppm), partes por billón (ppb), y partes por trillón (ppt), y se expresan de la siguiente manera:
– ppm = 1 mg soluto /1 L solución
– ppb = 1 μg soluto / 1 L solución
– ppt = 1 ng soluto / 1 L solución
En estas expresiones mg es igual a miligramos (0,001 g), μg es igual a microgramos (0,000001 g) y ng es igual a nanogramos (0,000000001 g). Estas unidades también pueden ser expresadas en función de volumen/volumen.
Unidades de concentración en función a moles
Las unidades de concentración basadas en moles son aquellas de la fracción molar, el porcentaje molar, la molaridad y la molalidad (estas dos últimas se describen mejor al final del artículo).
La fracción molar de una sustancia es la fracción de todas sus moléculas (o átomos) constituyentes en función de las moléculas o átomos totales. Se calcula de la siguiente manera:
XA = número de moles de la sustancia A / número total de moles en solución
Este procedimiento se repite para las otras sustancias en solución, tomando en cuenta que la suma de XA + XB + XC … debe ser igual a uno.
El porcentaje molar se trabaja de manera parecida a XA, solo que en función a porcentaje:
Porcentaje molar de A = XA x 100%
En la sección final se hablará sobre molaridad y molalidad de forma detallada.
Formalidad y normalidad
Por último, existen dos unidades de concentración que actualmente se encuentran en desuso: la formalidad y la normalidad.
La formalidad de una solución representa el número de peso-fórmula-gramo por litro de solución total. Se expresa como:
F = Nº P.F.G / L solución
En esta expresión P.F.G es igual al peso de cada átomo de la sustancia, expresado en gramos.
En cambio, la normalidad representa el número de equivalentes de soluto divididos entre los litros de solución, como se expresa a continuación:
N = equivalentes gramos de soluto / L solución
En dicha expresión los equivalentes gramos de soluto pueden calcularse por el número de moles H+, OH– u otros métodos, dependiendo del tipo de molécula.
3. Propiedades coligativas de las disoluciones y factores de solubilidad
1.- ¿Cómo se relaciona el grado de disociación de un soluto con la conductividad de ésta?
El soluto, sustancia que se encuentra en menor proporción en una disolución, puede ser de tipo iónico o molecular, lo que hace, que en algunos casos, las disoluciones conduzcan la corriente eléctrica, y en otros casos no.
Clasificación de solutos conductores y no conductores de la electricidad.
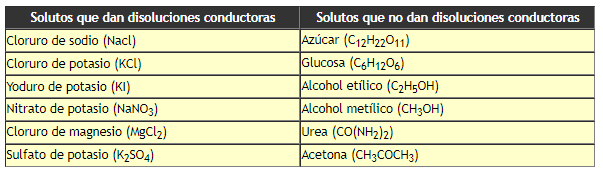
Los solutos que son capaces de generar disoluciones conductoras, se denominan electrolitos, y los solutos que no forman disoluciones conductoras de la corriente eléctrica se denominan no electrolitos.
Por otra parte, el comportamiento del soluto, también se ve influenciado por el disolvente en el cual se encuentra, ya que, por ejemplo, si se disuelve cloruro de sodio en agua, la disolución conduce la corriente, pero si se disuelve en benceno, la disolución no la conducirá.
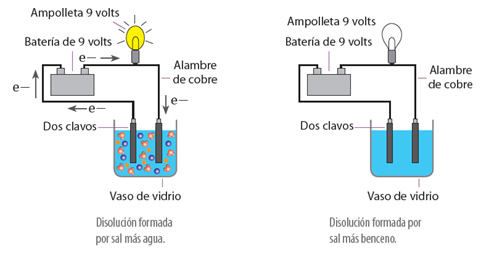
Esto sucede porque el cloruro de sodio en agua se disocia en iones cloruro (Cl-) y en iones sodio (Na+), ya que, el agua es un disolvente de naturaleza polar, es decir, presenta un polo positivo y otro negativo, por lo cual, al desplazarse por un conductor produce corriente eléctrica. En cambio, en el caso del benceno, que es un compuesto apolar, que presenta cargas simétricas, impide el desplazamiento de las cargas a través del conductor, por lo que no se genera la conducción.
Svante Arrhenius, en el 1887, fue quien explicó la conductividad eléctrica de las disoluciones, a través de su teoría de la disociación electrolítica.
Esta teoría indica que los electrolitos, en disolución o fundidos, se disocian en iones con carga eléctrica, de manera que la carga total sobre los cationes es igual a la carga total sobre los aniones. Por lo tanto, la disolución en conjunto será neutra.
Además, los iones son los átomos o grupos de átomos que forman los electrolitos. Los no metales forman iones negativos y los metales iones positivos.
Por ejemplo, la disociación del ácido clorhídrico, es:

La disociación del hidróxido de sodio, es:
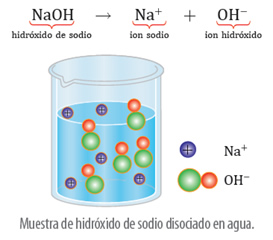
Otras expresiones de la disociación iónica son:

Que una disolución sea mejor o peor conductora, depende de la presencia de una gran cantidad de iones provenientes de la disociación total o casi completa del electrolito. Los solutos que producen disoluciones muy conductoras se denominan electrolitos fuertes, y las que producen disoluciones de baja conductividad se llaman electrolitos débiles, ya que la disociación es parcial. Es posible determinar el porcentaje de disociación de un electrolito en una disolución midiendo la conductividad eléctrica de la disolución o midiendo el descenso en el punto de congelación de la disolución.
Por ejemplo, si una disolución 0,1 molal de cloruro de sodio, presenta un descenso del punto de congelación de 0,34 °C, sin embargo, si fuese un compuesto que no sufriera disociación, la variación debería ser de 0,19 °C. Por otra parte, si el cloruro de sodio se disocia completamente, es decir, si un mol del compuesto genera dos moles de iones, la variación de la temperatura es de 0,38 °C. Por lo tanto, la disociación del cloruro de sodio, en esta disolución, no es total, por lo que, hay un número elevado de moléculas del compuesto que no se disocian. Ahora, para saber el porcentaje de disociación de la disolución, se debe tener en cuenta que cuando corresponde a 0% la variación es de 0,19°C, y cuando es 100%, la variación es de 0,38 °C, pudiendo hacer la siguiente relación, sabiendo que la temperatura experimental de la disolución con la que se trabaja es de 0,34 °C:
El cálculo del valor de X se obtiene por las diferencias entre los porcentajes y las variaciones de temperatura:
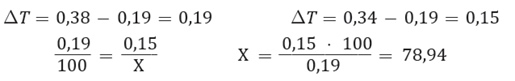
Por lo tanto, el cloruro de sodio en una disolución 0,1 molal se disocia en un 78,94%
Ahora, para poder determinar el porcentaje de disociación del cloruro de calcio en una disolución 0,075 molal que se congela a -0,32 °C, sabiendo que cuando no existe disociación la temperatura es igual 0,12 °C y cuando alcanza el 100% de disociación es 0,36°C, se deben seguir los siguientes pasos:
- En primer lugar, se deben determinar los datos a partir del enunciado:
- Sabiendo que la variación de temperatura de la disolución es -0,32°C y que el porcentaje de disociación del soluto está comprendido entre 0 y 100, se puede plantear la siguiente relación:
- Para despejar la X, se debe considerar las diferencias entre los porcentajes y las variaciones de temperatura:
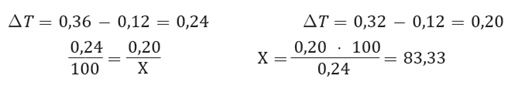
- Es posible concluir, que el cloruro de calcio en una disolución 0,075 molal se disocia un 83,33%
Generalmente, se designa como electrolitos débiles a aquellos electrolitos cuyo porcentaje de disociación es inferior a 10%, y como electrolitos fuertes a aquellos cuyo grado de disociación es igual o mayor a 40%.
2.- ¿Qué propiedades tienen las disoluciones?
Cuando un soluto y un disolvente dan origen a una disolución, la presencia del soluto determina una modificación de las propiedades que presenta el disolvente en estado puro, las que dan origen a las propiedades de la disolución, que pueden ser constitutivas o coligativas.
Las propiedades constitutivas son aquellas que dependen de la naturaleza de las partículas disueltas, por ejemplo, la viscosidad, la densidad, la conductividad eléctrica.
Por otra parte, las propiedades coligativas son aquellas que dependen del número de partículas disueltas en una cantidad fija de disolvente, es decir, la concentración de soluto, y no de la naturaleza de estas partículas. Son propiedades coligativas el descenso en la presión de vapor del disolvente, el aumento del punto de ebullición, la disminución del punto de congelación y la presión osmótica.
Se debe tener en consideración, al trabajar con las propiedades coligativas, que la concentración de la disolución no debe ser mayor a 0,2M, pues, teóricamente las fuerzas de atracción intermolecular entre soluto y disolvente serán mínimas, y no generaran errores.
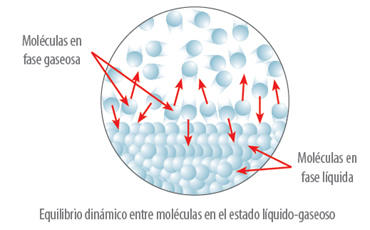
3.- ¿Qué es la presión de vapor y cómo se relaciona con las disoluciones?
Los líquidos tienen la capacidad de evaporarse, es decir, las partículas de la superficie del líquido tienden a salir de la fase líquida en forma de vapor. La presión que ejercen estas partículas que salen de la superficie y que chocan con la superficie del líquido por unidad de área se denomina presión de vapor
La presión de vapor varía según el líquido, dado que, las fuerzas de atracción entre sus moléculas tendrán su presión de vapor característica, además, ésta dependerá de la temperatura y de la naturaleza del líquido:
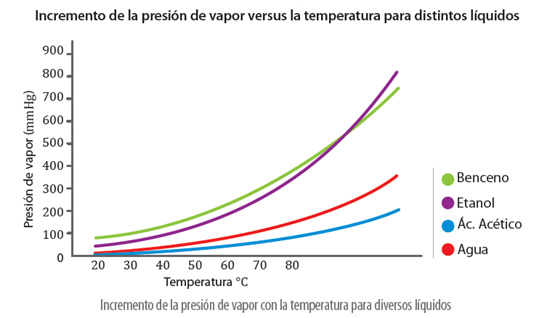
La presión de vapor aumenta con la temperatura, ya que, a medida que aumenta la temperatura, la energía cinética de las partículas aumenta, por lo que mayor cantidad de moléculas en estado gaseoso salen de la superficie del líquido ejerciendo mayor presión sobre él.
Por otra parte, líquidos que tienen una alta presión de vapor reciben el nombre de volátiles, como por ejemplo, el benceno y el etanol, y aquellos que presentan baja presión de vapor se denominan no volátiles, como el agua.
Ahora, una disolución que contiene líquidos no volátiles o solutos en estado sólido, va a presentar una presión de vapor más baja que el disolvente puro que la forma. Esto ocurre, porque cuando un soluto no volátil se disuelve en un líquido, parte del volumen total de la disolución es ocupado por moléculas de soluto, por lo tanto, hay menos moléculas de disolvente por unidad de área en la superficie, lo que origina el descenso de la presión de vapor del disolvente.
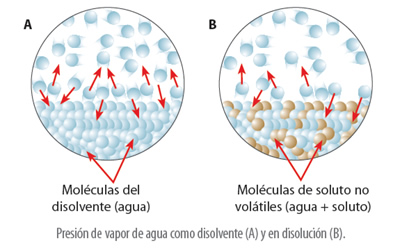
Este descenso de la presión de vapor por la presencia de solutos no volátiles se presenta en la Ley de Raoult, que dice que “la presión de vapor de un disolvente en una disolución es igual a la presión de vapor del disolvente puro multiplicada por la fracción molar del mismo en la disolución”. Expresado matemáticamente se puede decir que:
P = X disolvente • P disolvente puro
Xdisolvente corresponde a la fracción molar del disolvente en la disolución, es decir, la proporción de moles de disolvente que hay en el total de moles de disolución; y, P°disolvente puro es la presión de vapor del disolvente puro y P es la presión de vapor del disolvente en la disolución.
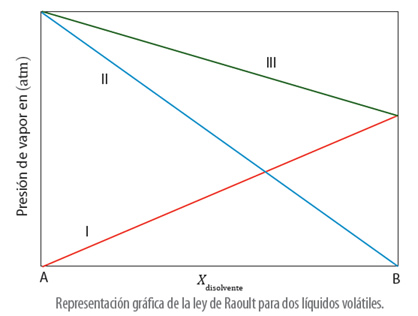
En el caso, de que una disolución esté formada por un soluto volátil, en la ley de Raoult, se sigue considerando que se tienen dos componentes, denominados A y B, que corresponden a las presiones del soluto y las presiones del disolvente:
![]()
Por lo tanto, como el soluto y el disolvente tienen una presión de vapor, la presión total del sistema será igual a la suma de las presiones parciales de cada componente:
![]()
La gráfica que muestra la ley de Raoult usando dos especies volátiles es:
Por ejemplo, para poder determinar la masa molar de un soluto que forma una determina disolución, sabiendo que la presión de vapor del agua pura a 25 °C es 23,76 mm de Hg, y la presión de vapor de una mezcla formada por 5,4 g de soluto no volátil en 90 g de agua es 23,32 mm de Hg, se deben seguir los siguientes pasos:
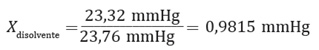
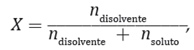
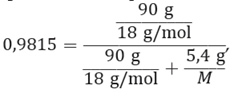
Al añadir un soluto a un disolvente, formando una disolución, el disolvente tiene un menor número de partículas que pasan al estado gaseoso, debido a la acción de las moléculas del soluto en la superficie, que lo evitan.
Esto provoca, un aumento en el punto de ebullición, ya que, la presión de vapor se igualará a la presión atmosférica a mayor temperatura.
Variación del punto de ebullición en función del aumento de la concentración de la disolución.
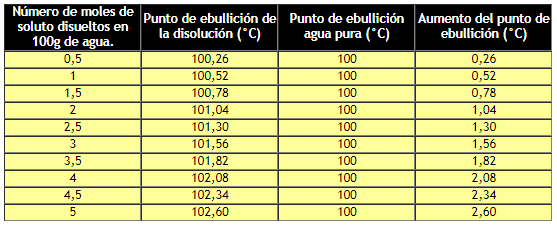
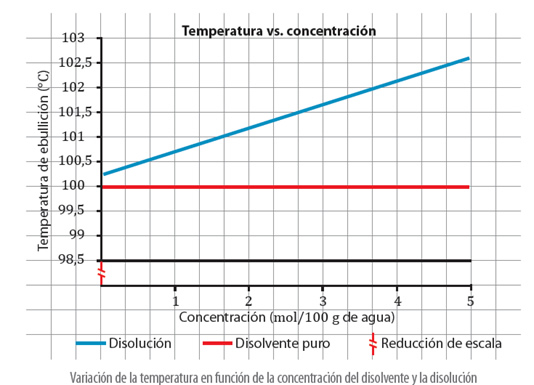
Si se grafican los datos anteriores, se tiene:


La disminución del punto de congelación de una disolución es proporcional a la concentración de la disolución, lo que se expresa de la siguiente manera:
![]()
De esta forma, m, corresponde a la concentración molal de la disolución, y Kf es la constante molal de la disminución del punto de congelación, valores conocidos y tabulados para cada disolvente.
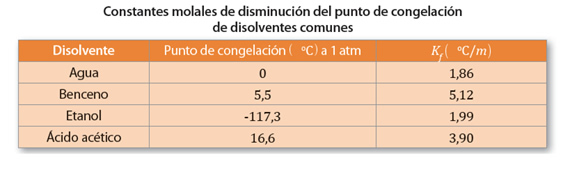
Ahora, el punto de congelación es menor en una disolución que cuando se tiene un disolvente puro, porque, al pasar de un estado líquido a uno sólido, el sistema se va ordenando, liberando energía cuando esto ocurre, y como en una disolución hay mayor desorden que en el disolvente puro, se requiere que se libere más energía para lograr el orden, por lo tanto, se tiene un menor punto de congelación.
Ahora, para poder saber el punto de congelación de una disolución que se ha preparado disolviendo 100 g de anticongelante etilenglicol en 900 g de agua, sabiendo que la constante molal de disminución del punto de congelación del agua es 1,86 °C/m, y que la masa molar del etilenglicol es 62 g/mol, se debe tener en consideración que:
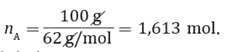
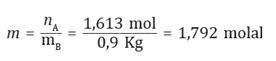
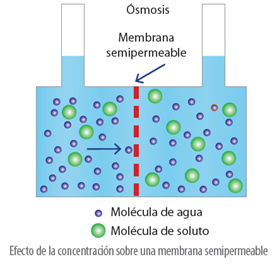
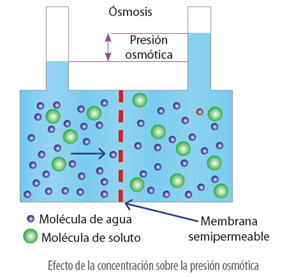
Esta diferencia de niveles de ambas disoluciones, genera una presión, denominada presión osmótica.
La presión osmótica es la presión necesaria para detener el flujo de disolvente a través de la membrana semipermeable que separa las dos disoluciones de diferentes concentraciones.
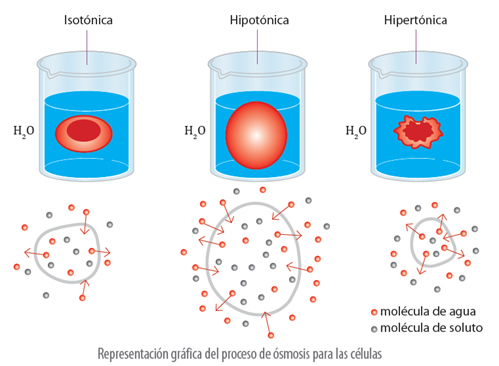
Las disoluciones, según la concentración que presenten, se pueden clasificar como isotónicas, hipertónicas e hipotónicas.
Las disoluciones isotónicas son aquellas que presentan igual concentración e igual presión osmótica. Las disoluciones hipertónicas son disoluciones que presentan diferentes presiones osmóticas y diferentes concentraciones, por lo que la disolución más concentrada se encuentra en el medio externo. Y, las disoluciones hipotónicas, son disoluciones que presentan diferentes presiones osmóticas y diferentes concentraciones, siendo la de menor concentración la que se encuentra en el medio externo.
El proceso de osmosis es muy fácil de visualizar en las células. Por ejemplo, cuando una célula se encuentra en una disolución cuya concentración es igual tanto fuera como dentro de ella, se dice que el líquido es isotónico, ya que, no hay intercambio a través de la membrana celular. Si en el medio exterior hay mayor concentración que en el interior de la célula, se dice que hay un líquido hipertónico, y las moléculas de agua pasan de la célula al exterior a través de la membrana plasmática, y la célula se contrae. Finalmente, si la célula se encuentra en un medio formado por una disolución de menor concentración que el interior de ella, se tiene un líquido hipotónico, produciéndose el paso de moléculas de agua hacia el interior de la célula, por lo que, la célula se hincha.
La presión osmótica obedece a una ley similar a la de los gases ideales. Esto se expresa a través de una ecuación, denominada la Ecuación de Van’t Hoff.
![]()
π corresponde a la presión osmótica, V es el volumen de la disolución, R es la constante de los gases ideales, que corresponde a 0,082 L atm/K mol, n es el números de moles de soluto y T es la temperatura en grados K.
De la ecuación de Van’t Hoff se deduce que a temperatura constante la presión osmótica solo depende del número de la concentración de partículas y no de la naturaleza de este, es por eso, que es una propiedad coligativa
Si el volumen de la disolución se trabaja en litros, sabiendo que la molaridad corresponde a los moles de soluto dividido en el volumen de disolución en litros, se tiene que:
π = M R T
Ahora, para conocerla concentración de glucosa que será isotónica con la sangre, sabiendo que la presión osmótica promedio de la sangre a 25 °C es 7,7 atm, se deben seguir los siguientes pasos:

7.- ¿Qué propiedades tienen las disoluciones formadas por electrolitos?
Si se compara el valor del punto de congelación de una disolución formada por un electrolito, como por ejemplo el cloruro de sodio, con otra formada por un no electrolito, como la sacarosa, se puede verificar que en el primer caso, la variación es el doble, que si se utiliza un no electrolito.
Disminución del punto de congelación de disoluciones de electrólito y no electrólito

Esto sucede porque un electrolito al disociarse forma partículas con carga eléctrica que se mueven dentro de la disolución. Estos iones con cargas opuestos chocan y se unen por breves momentos. Cuando se unen, los iones se comportan como una sola partícula, denominada par iónico, siendo el número de partículas libres limitado, lo que se demuestra en la disminución de la concentración molal de la disolución, y por lo tanto, en la disminución del punto de congelación, o en una elevación del punto de ebullición, o la disminución de la presión de vapor y la modificación de la presión osmótica.
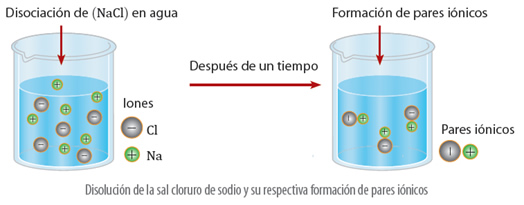
Este fenómeno, fue estudiado por Van’t Hoff, y él propuso que para demostrar los efectos que producen los electrolitos sobre las propiedades coligativas, debo utilizarse la siguiente expresión:
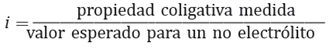
En este caso i, es el factor de Van’t Hoff, que indica el número de moles de que se producen cuando un mol de sustancia se disocia.
También, este factor puede determinarse, al observar la especie. Por ejemplo:

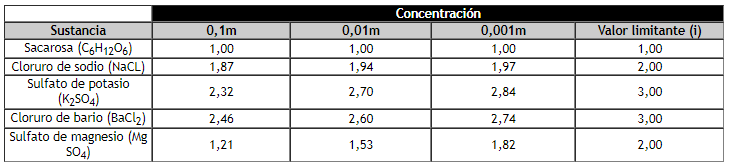
Se han tabulado los valores del factor de Van’t Hoff para varias sustancias a diferentes concentraciones.
Factores de van’t Hoff para diversas sustancias a 25°C
Por lo tanto, aplicando el coeficiente de Van’t Hoff a las expresiones de las propiedades coligativas, se tiene que estas corresponderán a:
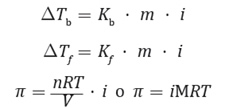
Ahora, para determinar la presión osmótica a 18 °C de una disolución acuosa de cloruro de sodio que contiene 3,5 g de sal en 100 mL de disolución, conociendo que el factor de Van’t Hoff es 1,83 y la masa molar del cloruro de sodio es 58,5 g/mol, se deben tener en consideración que: