CONSERVACIÓN DE LA MATERIA EN LOS PROCESOS SOCIOPRODUCTIVOS
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 5° - Ciencias Naturales: Química |
| Libro: | CONSERVACIÓN DE LA MATERIA EN LOS PROCESOS SOCIOPRODUCTIVOS |
| Impreso por: | Invitado |
| Fecha: | viernes, 4 de abril de 2025, 13:37 |
Tabla de Contenidos
- 1. Ley de la conservación de la materia en las reacciones químicas
- 2. Reactivo en exceso y reactivo limitante en una reacción química.
- 3. Rendimiento de una reacción en procesos productivos.
- 4. Leyes ponderales
- 5. Obtención del carbonato de litio y usos industriales, determinación de agentes tóxicos para el cuidado medioambiental.
1. Ley de la conservación de la materia en las reacciones químicas
Ley de conservación de la materia

La ley de conservación de la materia, conocida también como ley de conservación de la masa o simplemente como ley Lomonósov-Lavoisier (en honor a los científicos que la postularon), es aquel principio de la química que plantea que la materia no se crea ni se destruye durante una reacción química, sólo se transformado.
Este principio fundamental de las ciencias naturales fue postulado por dos científicos de manera simultánea e independiente: el ruso Mijaíl Lomonósov en 1748 y el francés Antoine Lavoisier en 1785. Llama la atención que esto ocurriera antes del descubrimiento del átomo y la postulación de la teoría atómica, con la cual es mucho más sencillo explicar e ilustrar el fenómeno.
La excepción a la regla la constituyen las reacciones nucleares, en las que es posible convertir masa en energía y viceversa, pudiendo “crearlas” y “destruirlas” a conveniencia, aunque realmente se esté transformando materia en energía y viceversa.
Junto a la equivalencia entre masa y energía, la ley de la conservación de la materia fue clave para la comprensión de la química contemporánea.
| Concepto: | En toda reacción química la masa se conserva, es decir, la masa total de los reactivos es igual a la masa total de los productos. |
Antecedentes de la Ley de conservación de la materia
La química de aquellos años entendía los procesos de reacción de manera muy distinta a la actual, en algunos casos llegando a afirmar lo contrario a lo que plantea esta ley.
Los experimentos de Robert Boyle en el siglo XVII, pesando distintos metales antes y después de dejarlos oxidar, atribuía el cambio en el peso a la ganancia de materia, ignorando que el óxido significaba la extracción de átomos de oxígeno del aire por parte del metal.
Descubrimiento de la Ley de conservación de la materia
Las experiencias que llevaron a Lavoisier al descubrimiento de este principio tienen que ver con uno de los principales intereses de la química de la época, como fue la combustión. Calentando diversos metales, el francés se dio cuenta de que éstos ganaban masa al calcinarse si se dejaban expuestos al aire, pero que su masa permanecía idéntica si estaban en envases cerrados.
Así, dedujo que esa cantidad extra de masa provenía de algún lado, y pudo proponer su teoría de que no era creada, sino tomada del aire. Por ende, en condiciones controladas, puede medirse la cantidad de masa de los reactivos antes del proceso químico y la cantidad de masa posterior, debiendo ser necesariamente idénticas, aunque ya no lo sea la naturaleza de los productos.
Ejemplo de la Ley de conservación de la materia
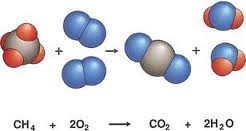
Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y “desaparecer”, cuando en verdad se habrá transformado en gases invisibles y en energía liberada.
Por ejemplo, al quemar metano (CH4) tendremos la siguiente reacción, cuyos subproductos serán gaseosos e invisibles, pero de una cantidad de átomos idéntica:
CH4 + 2O2 (del aire) CO2 + 2H2O (vapor de agua) + energía
1.1. Ley de la conservación de la materia en ecuaciones químicas | Química Inorgánica
2. Reactivo en exceso y reactivo limitante en una reacción química.
Una reacción química se produce en condiciones estequiométricas cuando las cantidades de reactivos (en moles) están en las proporciones idénticas a las de la ecuación química ajustada.
Es frecuente que se use un exceso de alguno de los reactivos para conseguir que reaccione la mayor cantidad del reactivo menos abundante.
El reactivo que se consume en su totalidad es el que va a limitar la cantidad de producto que se obtendrá y se denomina reactivo limitante. Los otros reactivos se llaman en exceso y no se consumen totalmente.
¿Cómo puedes saber cuál es el reactivo limitante? Por ejemplo, en la reacción del aluminio con el oxígeno para formar óxido de aluminio, mezclas para que reaccionen dos moles de aluminio con dos moles de oxígeno.
La ecuación ajustada es: 4 Al + 3 O2 → 2 Al2O3
y haciendo uso de la proporción estequiométrica entre el aluminio y el oxígeno:
![]()
![]()
Por tanto, únicamente reaccionan 1,5 moles de O2 y quedan sin reaccionar 0,5 moles de oxígeno. El reactivo limitante es el aluminio, que se consume totalmente.
El reactivo limitante
Cuando en una reacción química intervengan cantidades de dos o más reactivos, antes de realizar los cálculos estequiométricos debes determinar cuál es el reactivo limitante, ya que será la referencia para todos los cálculos relacionados con la ecuación química ajustada.
Obtención de cloruro de plata
La ecuación química ajustada es:
Calcula la cantidad de AgNO3 y de AlCl3, previo cálculo de las masas molares: M(AgNO3) = 169,9 g/mol ; M(AlCl3) = 133,5 g/mol
n(AgNO3) = 21,3 g de AgNO3 ∙ 1 mol de AgNO3 / 169,9 g de AgNO3 = 0,125 mol de AgNO3
La proporción estequiométrica indica que:
3 mol de AgNO3 / 1 mol de AlCl3 = 0,125 mol de AgNO3 / n(AlCl3)
Como 0,041 < 0,25 , el reactivo limitante es el AgNO3, que se consume totalmente, mientras que está en exceso el cloruro de aluminio.
¿Qué masa de reactivo excedente queda sin reaccionar?La cantidad de reactivo excedente que queda sin reaccionar es: 0,25 - 0,04 = 0,21 mol de AlCl3
¿Qué masa de cloruro de plata obtendrás?
Para calcular el cloruro de plata debes utilizar el reactivo limitante:
![]()
Quemando butano
El butano (C4H10) se utiliza como combustible, tanto para cocinar como para tener calefacción y agua caliente. El C4H10 se combina con el oxígeno para formar dióxido de carbono y agua.

Si haces reaccionar 23 g de butano con 96 g de oxígeno, ¿qué masa de CO2 se desprenderá?
Escribe la ecuación química ajustada: 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Calcula las masas molares de C4H10 y de O2: M(C4H10) = 58 g/mol ; M(O2) = 32 g/mol
Las cantidades de sustancia iniciales son:
n(C4H10) = 23 g de C4H10 ∙ 1 mol de C4H10 / 58 g de C4H10 = 0,4 mol de C4H10
n(O2) = 96 g de O2 ∙ 1 mol de O2 / 32 g de O2 = 3 mol de O2
La proporción estequiométrica indica que:
2 mol de C4H10 / 13 mol de O2 = 0,4 mol de C4H10 / n(O2)
n(O2) = 2,6 mol de O2
2,6 < 3 , por lo que el reactivo limitante es el C4H10
Para calcular la masa de CO2 debes partir de la masa del reactivo limitante, el C4H10:
![]()
2.1. Reactivo limitante y en exceso.
3. Rendimiento de una reacción en procesos productivos.
En general, cuando se produce una reacción química se obtienen menores cantidades de producto de las que cabria esperar teóricamente por la estequiometría de la reacción.
Los motivos son diversos, como por ejemplo:
- La reacción se produce en condiciones inadecuadas.
- Se pierde algo de la sustancia al manipularla.
- Existen reacciones alternativas o secundarias que dan lugar a productos no deseados.
Además, hay muchos casos en los que la conversión de reactivos en productos no es total por razones energéticas, independientemente de que se den las circunstancias anteriores.

Rendimiento de una reacción
Se define el rendimiento de una reacción química como:
![]()
Ahora vas a tener en cuenta el rendimiento en una reacción concreta.
Un método usado para reducir emisiones de cloruro de hidrógeno, que fue utilizado para obtener cloro antes de los procesos electrolíticos es la oxidación directa del HCl con el oxígeno, con el empleo de un catalizador y a alta temperatura.
La ecuación química ajustada del proceso es:
4 HCl + O2 → 2 Cl2 + 2 H2O
Partiendo de 27 g de HCl y con suficiente oxígeno, ¿cuál es la masa de Cl2 que obtendrás si el rendimiento de la reacción es del 36 %?
La secuencia de operaciones incluirá un factor que tenga en cuenta el rendimiento de la reacción:
Escribe la ecuación química ajustada: N2 + 3 H2 → 2 NH3
Calcula las masas molares de los reactivos y producto: M(N2) = 28 g/mol ; M(H2) = 2 g/mol ; M(NH3) = 17 g/mol.
Las cantidades de sustancia iniciales son:
La proporción estequiométrica indica que: 1 mol de N2 / 3 mol de H2 = 5 mol de N2 / n(H2)
n(H2) = 15 mol de H2
15 > 13 y el reactivo limitante es el H2
Para calcular la masa de NH3 debes partir de la masa del reactivo limitante, el H2.
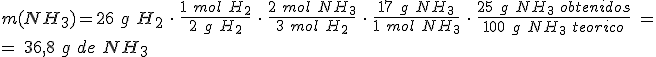
3.1. RENDIMIENTO DE REACCIÓN | Química Básica
4. Leyes ponderales
Introducción:
Las leyes ponderales son un conjunto de leyes que tienen como objetivo el estudio del peso relativo de las sustancias, en una reacción química, entre dos o más elementos químicos. Por lo tanto se puede decir que se divide en cuatro importantes leyes como lo son:
Ley de conservación de la masa o ley de Lavoisier. 1789:
Este resultado se debe al químico francés A. L. Lavoisier, quien lo formulo en 1774. Considerando que “La ley de la conservación de la masa dice que en cualquier reacción química la masa se conserva, es decir, la masa y la materia ni se crea ni se destruye, sólo se transforma y permanece invariable.”
Ley de las proporciones definidas o ley de Proust. 1801.
En 1808, tras ocho años de las investigaciones, Proust llego a la conclusión de que para formar un determinado compuesto, dos o más elementos químicos se unen y siempre en la misma proporción ponderal.
Ley de Dalton de las proporciones múltiples. 1803
Dalton elaboró la primera teoría atómica y realizó numerosos trabajos de los cuales formuló en 1803: “Cuando dos o más elementos pueden formar más de un compuesto, las cantidades de uno de ellos que se combinan con una cantidad fija del otro, guardan entre sí relación de números enteros sencillos”.
Ley de Richter a de las proporciones reciprocas o equivalentes, masas de combinación o masas equivalentes. 1792
Fue enunciada por el alemán J. B. Richter en 1792 y dice que los pesos de dos sustancias que se combinan con un peso conocido de otra tercera son químicamente equivalentes entre si.
Leyes ponderales:
Estas leyes reciben el nombre de ponderales por referirse al peso de las sustancias que reaccionan. Son leyes empíricas.
Ley de conservación de la masa o ley de Lavoisier. 1789:
Antoine Laurent de Lavoisier (1743-1794), químico francés, considerado el fundador de la química moderna.
Lavoisier nació el 26 de agosto de 1743 en París y estudió en el Instituto Mazarino. Fue elegido miembro de la Academia de Ciencias en 1768. Ocupó diversos cargos públicos, incluidos los de director estatal de los trabajos para la fabricación de la pólvora en 1776, miembro de una comisión para establecer un sistema uniforme de pesas y medidas en 1790 y comisario del tesoro en 1791. Trató de introducir reformas en el sistema monetario y tributario francés y en los métodos de producción agrícola. Como dirigente de los campesinos, fue arrestado y juzgado por el tribunal revolucionario y guillotinado el 8 de mayo de 1794.
Los experimentos de Lavoisier fueron de los primeros experimentos químicos realmente cuantitativos que se realizaron. Demostró que en una reacción química, la cantidad de materia es la misma al final y al comienzo de la reacción. Estos experimentos proporcionaron pruebas para la ley de la conservación de la materia y la masa. Lavoisier también investigó la composición del agua y denominó a sus componentes oxígeno e hidrógeno.
Algunos de los experimentos más importantes de Lavoisier examinaron la naturaleza de la combustión, demostrando que es un proceso en el que se produce la combinación de una sustancia con el oxígeno. También reveló el papel del oxígeno en la respiración de los animales y las plantas. La explicación de Lavoisier de la combustión reemplazó a la teoría del flogisto (Principio imaginado por Stahl en el siglo XVIII, que formaba parte de todos los cuerpos y era causa de su combustión.) en la cuales eran las sustancias que desprendían los materiales al arder.
Con el químico francés Claude Louis Berthollet y otros, Lavoisier concibió una nomenclatura química, o sistema de nombres, que sirve de base al sistema moderno. La describió en Método de Nomenclatura Química (1787). En Tratado elemental de química (1789), Lavoisier aclaró el concepto de elemento como una sustancia simple que no se puede dividir mediante ningún método de análisis químico conocido, y elaboró una teoría de la formación de compuestos a partir de los elementos. También escribió Sobre la Combustión (1777), y Consideraciones sobre la Naturaleza de los Ácidos (1778).
La ley de la conservación de la masa dice que en cualquier reacción química la masa se conserva, es decir, la masa y la materia ni se crea ni se destruye, sólo se transforma y permanece invariable.
Para Lavoisier los cambios en las sustancias no producían la creación o destrucción de materia. Experimentalmente (utilizó y perfeccionó la balanza) demostró que la suma de las masas de los reactivos es igual a la suma de las masas de los productos. " Durante un cambio químico no existe cambio en la masa de los reactivos al convertirse en productos". "
- ¿El hierro al oxidarse gana masa? ¿La madera al quemarse pierde masa?
En un sistema cerrado (Sin intercambiar materiales con el exterior) la masa total de las sustancias existentes no varia aunque se produzca cualquier reacción química entre ellas.
En las reacciones nucleares (no en las reacciones químicas habituales) hay una relación entre masa y energía E=mc2 .La masa se puede transformar en energía y la energía se puede transformar en masa. 100 kcal = 4.65x10-12 Kg.
Ley de las proporciones definidas a de la composición constante o ley de Proust. 1801.
La ley de Proust no se cumple exactamente. La causa es que la masa atómica promedio depende de la composición isotópica del elemento. Esta puede variar según su origen. Tampoco cumplen esta ley algunos sólidos iónicos, como el óxido de zinc o el sulfuro de cobre (II) o los semiconductores extrínsecos, debido a defectos en la red cristalina. Estas sustancias se llaman compuestos no estequiométricos o bertólidos en honor a Berthollet.
En 1808, tras ocho años de las investigaciones, Proust llego a la conclusión de que para formar un determinado compuesto, dos o más elementos químicos se unen y siempre en la misma proporción ponderal.
Por ejemplo, para formar agua H2O, el hidrógeno y él oxigeno intervienen en las cantidades que por cada mol, se indican a continuación:
1 MOL AGUA PESA : (2)1,008 gH + 15,999 gO = 18,015 g
Para simplificar los cálculos, se suele suponer que el peso atómico de H es 1 y él O es 16: 1 mol de agua = 2 + 16 = 18 g, de los que 2 son de H y 16 de oxigeno. Por tanto, la relación ponderal (o sea, entre pesos) es de 8g de oxigeno por cada uno de hidrógeno, la cual se conservara siempre que se deba formar H2O (en consecuencia, sí por ejemplo reaccionaran 3 g de H con 8 de O, sobrarían 2g de H).
Una aplicación de la ley de Proust es la obtención de la denominada composición centesimal de un compuesto, esto es, el porcentaje ponderal que representa cada elemento dentro de la molécula.
Ejemplo:
En la reacción de formación del amoniaco, a partir de los gases Nitrógeno e Hidrógeno:
2 NH3 ! N2 + 3 H2
las cantidades de reactivos que se combinaban entre sí, fueron:
NITRÓGENO | HIDRÓGENO |
28 g. | 6 g. |
14 g. | 3 g. |
56 g. | 12 g. |
Cuando dos o más elementos o compuestos se combinan para formar un mismo compuesto determinado, lo hacen siempre en una proporción en peso fija y constante. La composición centesimal de cualquier compuesto se mantiene constante.
Ley de Dalton de las proporciones múltiples. 1803
Dalton elaboró la primera teoría atómica y realizó numerosos trabajos fruto de los cuales es esta ley que formuló en 1803:
“Si dos elementos químicos se combinan para formar distintos compuestos y la cantidad de uno de ellos permanece fija, las cantidades del otro que se combinan con él están en una relación numérica sencilla”:
Por ejemplo: H2 + ½ O2 ® H2O
H2 + O2 ® H2O2
De la primera reacción tenemos la relación:
Masa de O2 16 8
—— = ——
Masa de H2 2 1
De la segunda reacción tenemos la relación:
Masa de O2 32 16
—— = ——
Masa de H2 2 1
Por lo tanto, la masa de O2 que se combina con una cantidad fija de H, para formar agua o agua oxigenada está en una relación numérica sencilla de 16/8 o lo que es lo mismo de 2/1.
Puede ocurrir que dos elementos se combinen entre sí para dar lugar a varios compuestos (en vez de uno solo, caso que contempla la ley de proust). Dalton en 1808 concluyo que: los pesos de uno de los elementos combinados con un mismo peso del otro guardaran entren sí una relación, expresables generalmente por medio de números enteros sencillos.
Ejemplo:
La combinación de una misma cantidad de Carbono (12 gramos) con distintas cantidades de Oxígeno.
C + O2 --> CO2 | 12 g. de C + 32 g. de O2 --> 44 g. CO2 |
C + ½ O --> CO | 12 g. de C + 16 g. de O2 --> 28 g. CO2 |
Se observa que las cantidades de oxígeno mantienen la relación numérica sencilla (en este caso "el doble")
32/16 = 2
Las cantidades de un mismo elemento que se combinan con una cantidad fija de otro para formar varios compuestos están en una relación de números enteros sencillos.
Si dos elementos forman más de un compuesto, las diferentes masas de uno de ellos que se combinan con la misma cantidad del otro, están en una proporción de números enteros y sencillos.
A + B C
x g y g
A + B D
x g z g
y/z = relación de números enteros y sencillos.
Ley de Richter a de las proporciones reciprocas o equivalentes, masas de combinación o masas equivalentes. 1792
En 1792, antes de que Proust y Dalton enunciaran sus leyes, Richter enunció esta ley:
“Si pesos de distintos elementos se combinan con un mismo peso de un elemento determinado, cuando esos elementos se combinen entre sí, sus pesos relativos serán múltiplos o submúltiplos de aquellos pesos”
Así, por ejemplo, en el oxido de hierro (II) (FeO) y en el monóxido de azufre (SO), la cantidad de oxígeno que se combina con los otros elementos es la misma, obteniéndose las siguientes relaciones:
Fe 56 S 32
—— = —— ; ------ = ————
O 16 O 16
Luego cuando el hierro y el azufre se combinen para formar sulfuro de hierro (II) (FeS) o sulfuro de hierro (III) (Fe2S3), sus pesos relativos serán múltiplos de los de su combinación con el oxígeno, es decir:
FeS: Fe 56 Fe2S3: Fe 56 . 2
—— = —— ; —— = ————
S 32 S 32 . 3
Ejemplo:
En las reacciones de una misma cantidad de Hidrógeno (1 gramo) con dos elementos distintos, observamos las cantidades de combinación:
N2 + 3 H2 --> 2 NH3 | 1 g. H2<-->4.66 g. N2 |
H2 + ½ O2 --> H2O | 1 g. H2<-->8 g. O2 |
Resulta que estas cantidades guardan una relación de números sencillos con las cantidades que se combinan entre sí entre Nitrógeno y Oxígeno, para formar el monóxido de nitrógeno:
N2 + O2 --> 2 NO | 28 g. N2<--> 32 g. O2 |
4.66/8 = (28/32)*4
Esto dio origen al concepto de PESO EQUIVALENTE:
Peso equivalente de un elemento es la cantidad del mismo que se combina con 8 g. de Oxígeno, o con 1.008 g. de Hidrógeno.
Las masas de elementos diferentes que se combinan con una misma masa de un elemento dado son las masas con que se combinan entre sí, o bien múltiplos a submúltiplos de dichas masas.
Se define la masa de combinación o peso equivalente de un elemento como la masa de este que se combina con 8 g de oxígeno. Se halló que la masa equivalente más pequeña era la del hidrógeno, a esta masa se le asignó el valor uno y se tomó como referencia. El peso equivalente de un elemento depende del tipo de compuesto formado.
Compuestos | Oxígeno | Hidrógeno | Cloro | Carbono | Calcio | Azufre |
1 | 1.0000g | 0.1260g | ||||
2 | 1.0000g | 4.4321g | ||||
3 | 1.0000g | 0.3753g | ||||
4 | 1.0000g | 2.5050g | ||||
5 | 1.0000g | 1.0021g | ||||
6 | 0.1260g | 4.4321g | ||||
7 | 4.4321g | 0.3753g | ||||
8 | 4.4321g | 4.0082g | ||||
9 | 0.1260g | 0.3753g | ||||
10 | 2.5050g | 2.0042g |
Conclusión:
Se puede decir q las leyes ponderales son un conjunto de leyes que se descubrieron por vía experimental y que hacen referencia a las relaciones que, en una reacción química, cumplen los pesos de las sustancias reaccionantes y de los productos de la reacción.
La cual las Leyes Ponderales se divide en cuatro leyes que son: Ley de Lavoisier o de la conservación de las masas, que trata, que en una reacción química, la suma de las masa de las sustancias reaccionantes debe ser igual a la suma de las masas de los productos o sea que la masa y la materia ni se crea ni se destruye, sólo se transforma y permanece invariable. Ley de Proust o de las proporciones constantes, dice, que cuando se crea una reacción química los elementos químicos que se unen siempre tienen la misma proporción ponderal o sea su peso relativo. Ley de Dalton o de las proporciones múltiples, cuando dos elementos se combinan para producir nuevos compuestos se concluyo que los pesos de uno de los elementos combinados con un mismo peso del otro guardan entre si una relación, expresable casi siempre por medio de números enteros sencillos, y por ultimo, la Ley de Richter o de los pesos equivalentes dice que los pesos de dos sustancias que se combinan con un peso conocido de otra tercera son químicamente equivalentes entre si.
5. Obtención del carbonato de litio y usos industriales, determinación de agentes tóxicos para el cuidado medioambiental.
El litio tiene múltiples aplicaciones: Fabricación de baterías para laptops, celulares y automóviles eléctricos (éstos subirán su demanda en extremo cuando se masifique su producción), aplicaciones médicas para problemas nerviosos, purificación del aire ambiente, en aleaciones para aeronáutica etc. y en el futuro podría usarse en la construcción de reactores de litio, para generar energía eléctrica. El carbonato de litio (Li2CO3) es el compuesto de litio más utilizado; un gramo de litio equivale a 5,32 gramos de carbonato de litio (CL).

Se extrae de salmueras donde existe en sales naturales como en el Salar de Atacama en Chile o en el Salar del Hombre Muerto y otros en Argentina, o de depósitos minerales como del espodumeno de Greenbush en Australia. Gran parte de la producción mundial de litio proviene de salmueras, cuyo costo de producción es mucho menor que de los depósitos minerales (según John McNulty $us 1.500-2300/ton y $us 4.200-4.500/ton respectivamente). Las reservas o los recursos de litio de Bolivia están en salmueras, que tienen una densidad aproximada a 1.200 gramos por litro (g/l), por lo que una concentración de litio de 0,1% en peso equivaldrá a 1.000 partes por millón (ppm) y 1,2 g/l.
Concentración de la sal de litio
La extracción de salmueras de litio se realiza mediante bombeo y su concentración por medio de la adsorción mediante un adsorbente selectivo del litio o de la evaporación en piscinas poco profundas construidas para el efecto. La evaporación además de elevar la concentración de las sales, hace que al saturarse algunas de éstas se vayan precipitando. La adsorción tiene las ventajas de que no es influida por la composición del agua salada (puede tratarse salmueras con bajas concentraciones de litio como experimentalmente se lo hace con el agua de mar), ni por las condiciones meteorológicas del lugar y no se generan muchos residuos y las desventajas que son necesarios reactivos, el equipo de adsorción es caro y complicado y el costo del adsorbente elevado. Las ventajas de la evaporación son que no se consume energía ni se utilizan muchos reactivos químicos, mientras que sus desventajas son la necesidad de usar simultáneamente otro método de separación, la acumulación de residuos y la dependencia de las condiciones meteorológicas del lugar (velocidad de evaporación y lluvias). Habiéndose elegido este último método para el Salar de Uyuni (con el que funcionará la planta piloto ya instalada), solo se hará una breve descripción de éste.
La mayor producción mundial de litio proviene de las salmueras del Salar de Atacama en Chile, donde se utiliza el método de evaporación y del que se tienen datos y muchos factores de operación, que permiten su comparación con los del Salar de Uyuni. Las salmueras de Atacama son más ricas que las de Uyuni en litio (también en potasio y boro), por lo que la relación Mg/Li, nociva para la concentración del litio es de 6/1 y 19/1 respectivamente. Mientras que la evaporación y la pluviometría son de 3.200 mm/año y 10-15 mm/año en Atacama, en Uyuni son de 1.500 mm/año y 200-500 mm/año, vale decir que en Uyuni la evaporación es menor y la lluvia mucho mayor, lo que retardará bastante la evaporación. En Atacama el proceso de evaporación que concentra el litio de 0,15% a 6% (40 veces) dura de 12 a 18 meses, por lo que es de prever que en Uyuni la evaporación dure mucho más, especialmente con lluvias intensas como las ocurridas últimamente que anegaron las piscinas de evaporación de la planta piloto.
El estudio de laboratorio "Tratamiento químico de salmueras del Salar de Uyuni-Potosí" realizado en 1987 en Francia mediante el Convenio UMSA-ORSTOM (Instituto francés de investigación científica para el desarrollo), simulando en 5 vasos las condiciones de las piscinas de evaporación, estableció que precipita primero el cloruro de sodio (NaCl) y casi en seguida el cloruro de potasio (KCl). Como el cloruro de magnesio (MgCl2) no puede ser separado con la evaporación, lo que complica el proceso, se lo precipita como hidróxido de magnesio (Mg(OH)2) añadiendo cal.
Precipitación y refinación del CL
El cloruro de litio adecuadamente concentrado en los 5 vasos fue lavado con hidróxido de sodio para eliminar las posibles trazas de magnesio y calcio restantes, para finalmente precipitarlo como CL utilizando carbonato de sodio. La recuperación media del litio fue de 80,8% y la pureza media del CL 94,4%.
Tres pruebas de laboratorio recientemente realizadas con 25 litros de salmuera del Salar de Uyuni con 0,107% de litio, en el National Institute of Advanced Industrial Science and Technology del Japón, para la obtención de litio por el método de adsorción, dieron CL con una pureza superior al 99,8% y una recuperación media de 73%. Este método es empleado en el Salar del Hombre Muerto, Argentina, que contiene 0,06% de litio.
El CL obtenido por cualquier método debe ser purificado, secado y cristalizado. A pesar del alto contenido de litio en el Salar de Atacama y la experiencia en su obtención, se indica que su recuperación es del 42%. El CL a utilizarse en la fabricación de baterías para vehículos eléctricos debe tener una pureza de por lo menos 99,95%, por lo que el CL obtenido por precipitación debe ser refinado a través de varias reacciones y etapas de recristalización, en algunos casos mediante una resina de intercambio iónico. Debido a que el proceso de refinación tiene costo y su recuperación es menor luego de cada etapa (en la etapa de refinación se estima en aproximadamente 70%), cuanto mayor la pureza del CL, su precio se incrementa en mucho mayor proporción.
Aunque el método descrito para la obtención de CL parece sencillo, como todo proceso industrial requiere de tecnología y logística adecuadas, de técnicos experimentados y personal entrenado. La evaluación del funcionamiento de la planta piloto permitirá confirmar o cambiar el proceso de concentración de litio mediante piscinas de evaporación.
Los salares son cuencas cerradas donde queda almacenada el agua, donde a lo largo de miles de años se han concentrado minerales y elementos químicos que fueron arrastrados por la lluvia desde las laderas montañosas.

«La existencia de costras sólidas de sal es sólo una característica superficial que está presente en algunos salares, pero no es representativa de la complejidad del sistema. Un salar tiene asociado un cuerpo subterráneo de salmuera que lo alimenta, y tiene diferentes ‘facies’ de sales en profundidad, como cloruro de sodio (halita), cloruros y sulfatos de potasio y magnesio, y otros sulfatos y carbonatos», explica el doctor Fernando Díaz, geólogo forense y ambiental independiente.
Como toda actividad minera, la explotación de litio no deja afuera la preocupación por el impacto ambiental y social de exploración y de extracción. Quizás un debate importante surge de este mineral en particular por ser hoy uno de los elementos primordiales en la evolución de automóviles eléctricos y aparatos electrónicos con bajo consumo energético, y en este sentido, su explotación gana adeptos en la mitigación del cambio climático y en el esfuerzo por revertir el calentamiento global.
El impacto ambiental de la extracción de litio no es por esto de menor envergadura que otros metales, ni tampoco deja de ser un importante factor en la discusión sobre el uso del territorio, cuando existen por ejemplo, reclamos sobre los mismos por comunidades originarias. Es en este sentido por ejemplo, encontramos resistencia de comunidades indígenas en Argentina, que piden la suspensión de varios proyectos de explotación de litio, por encontrarse en sus legítimos territorios.
Los principales impactos ambientales de la extracción de litio no difieren en gran medida de la extracción de otros minerales: consumo y contaminación de agua, impactos en el paisaje, introducción de caminos de exploración en ecosistemas sensibles, instalación de infraestructura, impacto en la flora y fauna de la actividad industrial donde antes no la había, generación de residuos sólidos y químicos, etc.
El litio reacciona con el vapor de agua, con el nitrógeno, el oxígeno y en el aire. Cuando entra en contacto con el ambiente y su superficie forma carbonato de litio, hidróxido de litio y nitrato de litio. Entre ellos el hidróxido de litio es particularmente peligroso debido a su potencialidad extremadamente corrosiva, debiéndose prestar especial atención a su impacto en organismos acuáticos.
En el proceso de producción se presenta un potencial peligro en cuanto a que las sustancias pueden contaminar las aguas subterráneas, reservas de agua potable para comunidades. Algunas alternativas que vemos para minimizar el riesgo de este tipo de contaminación es la producción con aguas ya contaminadas o no aptas para consumo humano. Este es el caso por ejemplo de la planta piloto del Salar de Uyuni de la COMIBOL (Corporación Minera de Bolivia) donde han sustituido partes el agua potable para la producción con agua salina del Río Grande de Lípez.
En zonas del norte argentino y chileno, en las cuales se extrae litio, zonas extremadamente áridas, el uso de agua potable para la extracción y producción del mineral es un riesgo para la sustentabilidad de la zona.
En Bolivia, la situación es similar. Grupos ambientalistas argumentan que el litio causará una gran crisis de agua; y que la región ya sufre de una seria escasez hídrica que afecta a los productores de quinua, a la crianza de llamas, a la vital industria del turismo, y a las fuentes de agua potable. Aunque los funcionarios bolivianos aseguran que las necesidades de agua para la producción de litio serán mínimas, sus estimaciones se basan en información muy limitada e incompleta haciendo difícil una verdadera mensura de la situación.
Es la base de las críticas la información acotada, que produce dudas y cuestionamientos, a su vez esto no es acompañado con políticas protectoras legislativas. La comunidad local es la que mayormente se muestra preocupada, ya que allí se cambia toda su forma de vida y si tomamos en cuenta que en «la naturaleza comercial del litio» a la que referimos, esa concentración empresarial hace que las ganancias de mercado sean atraídas por estos sectores, entonces será necesario indagar en los patrones de justicia para tomar una decisión que conforme tanto al sector empresarial como comunidades locales afectadas y mas allá aun será necesario indagar qué sucederá en el largo plazo. Los países han desarrollado distintos puntos de vista para la explotación expresados en sus políticas de acción. Aun así, la falta de información sobre las precisiones y delicadeza con la que se debería tomar el tema, es preocupante.
El impacto ambiental es innegable, y en la explotación del litio podemos observar la mayor afectación en: Crisis de agua Forma de vida: cría de llamas, animales, etc.
La contaminación del aire, del agua y de los suelos en la extracción del litio es generalmente una gran preocupación. Se necesitarán enormes cantidades de químicos tóxicos, carbonato de sodio, bases y ácidos para procesar el litio. El escape de dichos químicos por medio de la lixiviación, derramamiento o emisiones atmosféricas pone en peligro a comunidades y al ecosistema.
Informes sobre el Salar de Atacama en Chile describen un paisaje marcado por montañas de sal descartada y enormes canales llenos de agua azul contaminada con químicos. Frente a estas realidades los funcionarios gubernamentales bolivianos han minimizado dichos riesgos, pese a que los informes medioambientales no ofrecen garantías para evitar dicho escenario, sumado a la falta generalizada tanto en Bolivia como también en Argentina y Chile, de controles estatales sobre el sector.
La garantía de los informes debiera de ser la piedra angular del cual se tomaran todas las decisiones, y a pesar de ello la información brindada no satisface la exigencia de la población.
El biólogo Rodolfo Tecchi, hablando de la explotación de litio en la provincia de Jujuy Argentina, enumera algunos de los efectos posibles de la minería del litio «Por un lado, se verá afectada la superficie de la costra del salar, porque la obtención del mineral implica la construcción de piletas de evaporación que, en conjunto, pueden sumar entre 300 y 600 hectáreas de superficie. Para el especialista, es necesario analizar el funcionamiento integral del salar pues, en tanto se extrae la salmuera, se pueden deprimir las napas de agua a donde lleguen los extractores.
«También hay que considerar –acotó Tecchi– que, en la provincia de Jujuy, una de las áreas donde se prevé la extracción fue declarada, hace más de treinta años, reserva provincial para la protección de la vicuña». Y agregó: «Teniendo en cuenta que cada sitio es diferente, hay que estudiar cada caso en particular, y ver los planes de las empresas para el control del impacto. Dado que son explotaciones muy rentables, no debería haber problemas en derivar una parte sustancial de las ganancias a cubrir el impacto».