FUERZAS DE UNIÓN Y ENLACE QUÍMICO EN LA MADRE TIERRA
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 2° - Ciencias Naturales |
| Libro: | FUERZAS DE UNIÓN Y ENLACE QUÍMICO EN LA MADRE TIERRA |
| Impreso por: | Invitado |
| Fecha: | sábado, 23 de noviembre de 2024, 16:37 |
1. Modelos atómicos, el modelo actual
La materia está compuesta por partículas muy pequeñas a las que llamamos átomos. Al tratarse de partículas tan pequeñas, hace muchos años, era muy difícil poder explicar cómo estaban formados.
Los científicos trataban de explicar, con las herramientas que disponían, cuál era la estructura del átomo. A través del tiempo, se fueron planteando diferentes Modelos Atómicos que llevan el nombre del científico que lo ideó.

Estos Modelos Atómicos se fueron descartando, mejorando y planteando nuevos, hasta llegar al Modelo Atómico actual.
Aquí te explicaremos la evolución histórica de los Modelos Atómicos, las características de cada uno ellos y al final encontrarás un resumen de los Modelos Atómicos.
¿Cuántos Modelos Atómicos hay?
Los Modelos Atómicos más destacados y trascendentes, hasta la fecha, son 8 (ocho).
Modelo Atómico de Demócrito
Demócrito, un filósofo griego, aproximadamente en el 450 a.C., desarrolló la “teoría atómica del universo”, que fue concebida por su mentor, el filósofo Leucipo.

Esta teoría, no se apoya en resultados experimentales sino que se desarrolla mediante razonamientos lógicos, por ser una teoría filosófica.
- Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
- Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
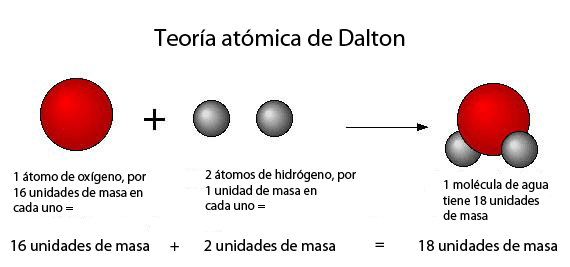
Modelo Atómico de Dalton
Fue desarrollado a principios de 1800 (se estima, entre 1803 y 1807) por el científico británico John Dalton. Fue el primer modelo atómico con bases científicas. A su modelo atómico Dalton lo llamó “Teoría Atómica”).
El Modelo Atómico de Dalton tiene los siguientes enunciados:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa e iguales propiedades. Los átomos de diferentes elementos tienen masa diferente. Comparando la masa de los elementos con los del hidrógeno tomado como la unidad, propuso el concepto de peso atómico relativo.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos, guardan relaciones simples de números enteros y pequeños.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos.
- Los átomos están formados por partículas subatómicas y son divisibles.
- Existen átomos del mismo elemento con diferentes masa (Isótopos).
- Existen moléculas formadas por 2 o más átomos del mismo elemento (Por ejemplo O2; H2, etc).
- Este modelo no explica la regularidad de la Tabla periódica desarrollada por Mendeleiev en 1869.
Modelo Atómico de Lewis: Modelo atómico cúbico
Esta teoría se desarrolló en 1902 por G. Lewis, pero fue publicada en 1916 en el artículo «The Atom and the Molecule» (El átomo y la molécula).
El modelo atómico de Lewis representa al átomo como un cubo, donde los electrones están colocados en cada uno de los 8 vértices de ese cubo.
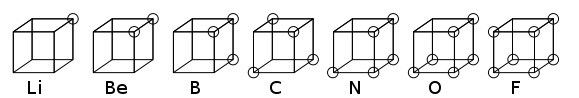
Gráfico: Átomo según el Modelo Atómico Cúbico de Lewis. Se representan los elementos del período de de la tabla periódica. Los electrones son los círculos dibujados en los vértices de cada cubo.
El Modelo Atómico Cúbico representó un paso importante hacia el entendimiento del enlace químico, ya que introdujo el concepto de "valencia de un átomo", es decir, la cantidad de electrones en el último nivel de energía del átomo que se pondrán en juego en un enlace químico.
El artículo de 1916 de Lewis también introdujo:
. El concepto del par de electrones en el Enlace Covalente.
. La regla del octeto.
. La Estructura de Lewis.
El modelo del átomo cúbico se abandonó pronto y es, por tanto, sólo de interés histórico.
Modelo Atómico de Thomson (o Pudín de Pasas)Fue desarrollado en 1906 por el científico británico Joseph John "J.J." Thomson, quien unos años antes había descubierto el electrón.
En este modelo, el átomo está compuesto por electrones de carga negativa en un átomo de carga positiva. Los electrones se hallan incrustados en este al igual que las pasas de un pudín (o budín). Por esta analogía también se lo denomina “Modelo del pudín de pasas”.
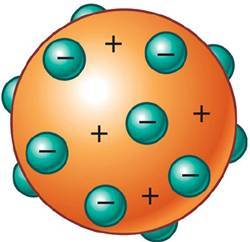
Gráfico: Átomo según el Modelo Atómico de Thomson. Los electrones son las cargas negativas en color verde, incrustadas en una estructura con carga positiva en color naranja.
La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
- Hace predicciones incorrectas sobre la distribución de las cargas dentro de los átomos.
- Tampoco explica la regularidad de la Tabla periódica que había sido desarrollada por Mendeleiev en 1869
Este modelo fue propuesto en 1911 por el químico y físico británico-neozelandés Ernest Rutherford. Este científico había desarrollado un experimento denominado ”experimento de la lámina de oro” el cual le permitió enunciar el modelo atómico.
Fue el primer modelo en separar al átomo en dos zonas: núcleo y corteza. A partir de aquí, se empezaron a estudiar por separado.
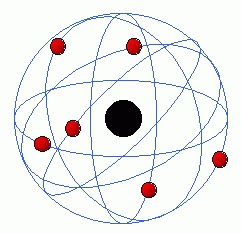
Gráfico: Átomo según el Modelo Atómico de Rutherford. Los electrones están representados por las esferas de color rojo, que se encuentran girando en órbitas circulares alrededor del núcleo (esfera negra)
Según este modelo:
- El átomo consta de un núcleo central donde se concentra la carga positiva y casi toda la masa. Este núcleo es muy pequeño comparado con el tamaño total.
- El átomo posee electrones, de carga negativa que se sitúan en la corteza, describiendo órbitas circulares y girando a gran velocidad, como un sistema planetario.
- La suma de las cargas negativas de los electrones deben ser igual a la carga positiva del núcleo, siempre que el átomo sea neutro.
- Contradice la teoría electromagnética clásica: Según esta teoría, toda carga acelerada (el electrón en órbita lo es por tener aceleración centrípeta), debe irradiar energía continuamente en forma de ondas electromagnéticas. De acuerdo con el principio de conservación de la energía, la velocidad del electrón debería disminuir y caer en espiral hacia el núcleo. Esto no ocurre.
- No permite explicar los espectros de emisión de los elementos.
Modelo atómico de Bohr
Fue postulado en 1913 por el físico danés Niels Bohr. Puede considerarse transicional ya que se ubica entre la mecánica clásica y la cuántica. Incorpora ideas tomadas del efecto fotoeléctrico, explicado por Einstein.
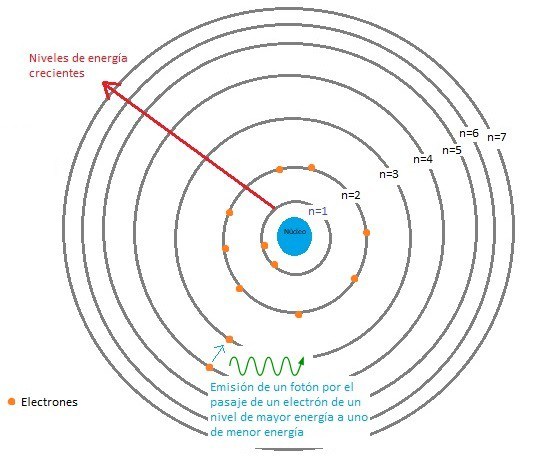
Gráfico: Átomo según el Modelo Atómico de Bohr.
El núcleo atómico está representado de color celeste, los electrones con color naranja. Los círculos alrededor del núcleo son las órbitas en las que giran los electrones. Cada una de esas órbitas se corresponde con un número cuántico principal que puede tomar valores enteros positivos del 1 al 7. Además está representada la energía emitida en forma de fotón por un electrón que pasa de un nivel de mayor a uno de menor energía.
A partir de la idea de que en un átomo los electrones giran alrededor del núcleo, Bohr propuso 5 postulados:
1. El electrón sólo puede moverse a cierta distancia (radio) del núcleo, lo que determina una órbita o nivel de energía (también se lo llama capa). Una órbita es una trayectoria circular bien definida alrededor del núcleo.
2. Mientras se encuentre en una órbita, el electrón no libera ni absorbe energía; por esto se conoce a las órbitas como estacionarias (o permitidas). En una órbita, la energía permanece constante.
3. Cuando se le entrega energía a un átomo, el electrón puede absorberla y pasar a una órbita de mayor radio y mayor energía. En este caso, se dice que el electrón está en estado excitado. Cuando los electrones de un átomo no están excitados, el átomo se encuentra en estado fundamental.
4. Cuando un electrón pasa de una órbita más alejada del núcleo a otra más cercana entonces libera o emite energía en forma de fotón (una cantidad pequeña y determinada de energía).
5. Para pasar de una órbita a otra, el electrón debe absorber o emitir una cantidad de energía igual a la diferencia de energía entre un nivel y el otro (esto es porque la energía no se destruye, sino que se transforma ). Si pasa de un nivel inicial ( con una cantidad de energía Ei ) a otro final ( con otra cantidad de energía Ef ), la diferencia ( ∆E ) se calcula como ∆E = Ef - Ei . El electrón sólo puede hallarse en alguna de las órbitas y no en los espacios entre ellas. A las órbitas se las designa con el número cuántico n, que toma los valores: 1, 2, 3, 4, 5, 6 y 7. Cuanto más alejada del núcleo, más energía tiene la órbita.
El valor de ∆E entre dos capas sucesivas (entre 2 y 1; entre 3 y 2; entre 4 y 3; etc.) es cada vez menor, ya que la separación entre las órbitas es cada vez menor.
Si un átomo tiene electrones excitados, se lo escribe con un asterisco para identificarlo: Átomo excitado = X* (la letra X representa el símbolo del elemento). Por ejemplo, en el caso del sodio sería: Na* .
Insuficiencias del modelo atómico de Bohr:
En los espectros realizados para átomos de elementos que no fueran Hidrógeno, se observa que electrones de un mismo nivel energético tienen distinta energía, mostrando un error en lo propuesto. Más tarde se descubrirán los subniveles energéticos.
Modelo atómico de SommerfeldFue desarrollado en 1916 por el físico alemán Arnold Sommerfeld, basándose en la teoría de la relatividad de Albert Einstein, por lo que se dice que es un modelo atómico relativista.
Hizo modificaciones al modelo de Bohr. Aún así, sigue siendo válido para el átomo de Hidrógeno, pero al tratar de explicar el comportamiento de átomos de otros elementos, presenta insuficiencias.
El modelo atómico de Sommerfeld postula que:
- Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
- A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel.
- El electrón es una corriente eléctrica minúscula.
- El núcleo atómico, al igual que los electrones, se mueven alrededor de un centro de masas del sistema. Ese centro de masa estará muy cercano al núcleo ya que su masa es muy superior a la masa de los electrones. Esta modificación la introdujo para justificar los valores de frecuencias halladas experimentalmente (en relación a las calculadas teóricamente).
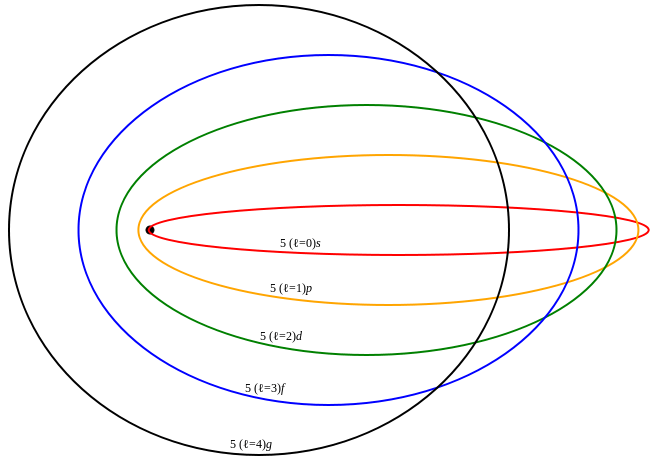
Gráfico: Átomo según el Modelo Atómico de Sommerfeld.
Cada una de las órbitas circulares o elípticas están representadas con un color diferente. En esas órbitas se mueven los electrones.
Si comparamos el modelo atómico de Sommerfeld con el de Bohr, observamos dos modificaciones básicas:
- El modelo de Sommerfeld plantea órbitas casi elípticas para los electrones. En el modelo de Bohr los electrones sólo giraban en órbitas circulares. Esto introdujo un nuevo número cuántico: Número cuántico azimutal (l) que describe la forma de los orbitales.
- El modelo atómico de Sommerfeld postula velocidades relativistas.
Modelo atómico de Schrödinger
Fue desarrollado en 1926 por el físico y filósofo austríaco Erwin Rudolf Josef Alexander Schrödinger. Es un modelo cuántico no relativista.
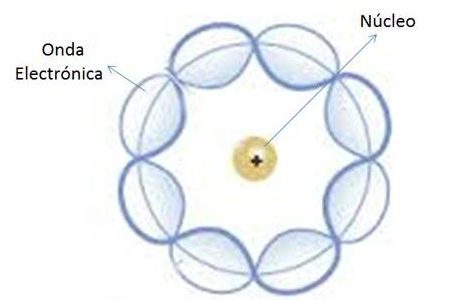
Gráfico: Átomo según el Modelo Atómico de Schrödinger
Insuficiencias del modelo atómico de Schrödinger:
Si bien el modelo de Schrödinger describe adecuadamente la estructura electrónica de los átomos, resulta incompleto en otros aspectos:
- En su formulación original (más tarde sufrió modificaciones) no tiene en cuenta el espín de los electrones.
- Ignora los efectos relativistas de los electrones rápidos.
- No explica por qué un electrón en un estado cuántico excitado decae hacia un nivel inferior si existe alguno libre.
Características del Modelo atómico de Schrödinger:
- Describe el movimiento de los electrones como ondas estacionarias.
- Postula que los electrones se mueven constantemente, es decir, no tienen una posición fija o definida dentro del átomo.
- Establece una zona de probabilidad para ubicar al electrón, no predice la ubicación del electrón.
- Las áreas de probabilidad donde se hallaría el electrón se denominan orbitales atómicos. Los orbitales describen un movimiento de traslación alrededor del núcleo del átomo.
- Estos orbitales atómicos tienen diferentes niveles y subniveles de energía, y pueden definirse entre nubes de electrones.
- El modelo no contempla la estabilidad del núcleo, sólo se remite a explicar la mecánica cuántica asociada al movimiento de los electrones dentro del átomo.
Modelo atómico actual
Fue desarrollado durante la década de 1920, principalmente por Schrödinger y Heisenberg.
Se trata de un modelo de gran complejidad matemática, hasta el punto de que al utilizarlo sólo se puede resolver con precisión el átomo de hidrógeno. Se utilizan métodos aproximados para resolver átomos distintos del hidrógeno.
En cualquier caso, el modelo atómico mecánico-cuántico encaja muy bien con las observaciones experimentales.
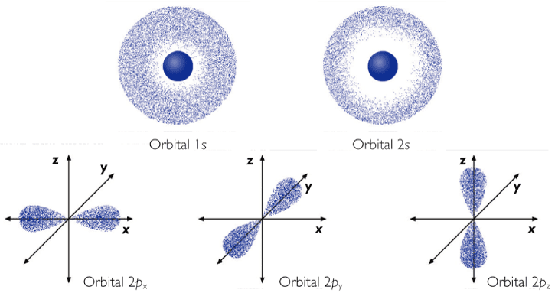
De este modelo diré que no se habla de órbitas, sino de orbitales. Una órbita es una región del espacio en la que la probabilidad de encontrar el electrón es máxima. Las órbitas atómicas tienen diferentes formas geométricas.
En la simulación de la derecha se puede elegir entre diferentes tipos de orbitales y observar su forma geométrica.
Modelo Atómico Actual y sus Características
Los principios básicos del modelo actual son: La presencia de un núcleo atómico con partículas conocidas, casi toda la masa atómica en un volumen muy pequeño. Los estados estacionarios o niveles de energía fundamentales en los que los electrones se distribuyen en función de su contenido energético.
Partículas atómicas y modelos atómicos: Desde la antigüedad, los humanos se han preguntado de qué está hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideraba que la materia estaba formada por partículas diminutas que no podían dividirse en partículas más pequeñas. Por esta razón, llamó a estas partículas átomos, que en griego significa indivisible. Demócrito atribuyó a los átomos las cualidades de eterno, inmutable e indivisible.

La imposibilidad de dar una explicación teórica satisfactoria de los espectros de los átomos con más de un electrón con los principios de la mecánica clásica, condujo al desarrollo del modelo atómico actual que se basa en la mecánica cuántica.
- El electrón se comporta como una onda en su movimiento alrededor del núcleo
- No es posible predecir la trayectoria exacta del electrón alrededor del núcleo
- Existen varias clases de orbitales que se diferencian por su forma y orientación en el espacio; así decimos que hay orbitales: s, p, d, f.
- En cada nivel energético hay un número determinado de orbitales de cada clase.
- Un orbital atómico es la región del espacio donde existe una probabilidad aceptable de que se encuentre un electrón. En cada orbital no puede encontrarse más de dos electrones.
- Principio de onda-partícula de Broglie: Señala que la materia y la energía presentan caracteres de onda y partícula; que los electrones giran por la energía que llevan y describen ondas de una longitud determinada.
- Principio estacionario de Bohr: El mismo que señala que un electrón puede girar alrededor del núcleo en forma indefinida.
- Principio de incertidumbre de Heisenberg: Determina que es imposible conocer simultáneamente y con exactitud la posición y velocidad del electrón.
1.1. Modelos atómicos
1.2. Modelo atomico actual
2. Propiedades físicas y químicas de las partículas subatómicas
Una partícula subatómica es una partícula más pequeña que el átomo. Puede ser una partícula elemental o una compuesta, a su vez, por otras partículas subatómicas, como son los quarks, que componen los protones y neutrones.
Los primeros modelos atómicos consideraban básicamente tres tipos de partículas subatómicas: protones, electrones y neutrones. Más adelante el descubrimiento de la estructura interna de protones y neutrones, reveló que estas eran partículas compuestas. Además el tratamiento cuántico usual de las interacciones entre las partículas comporta que la cohesión del átomo requiere otras partículas bosónicas como los piones, gluones o fotones.
Los protones y neutrones por su parte están constituidos por quarks. Así un protón está formado por dos quarks up y un quark down. Los quarks se unen mediante partículas llamadas gluones. Existen seis tipos diferentes de quarks (up, down, bottom, top, extraño y encanto). Los protones se mantienen unidos a los neutrones por el efecto de los piones, que son mesones compuestos formados por parejas de quark y antiquark (a su vez unidos por gluones). Existen también otras partículas elementales que son responsables de las fuerzas electromagnética (los fotones) y débil (los neutrinos y los bosones W y Z).
- Protón: Se encuentra en el núcleo. Su masa es de 1,6×10-27 kg.[1] Tiene carga positiva igual en magnitud a la carga del electrón. El número atómico de un elemento indica el número de protones que tiene en el núcleo. Por ejemplo el núcleo del átomo de hidrógeno contiene un único protón, por lo que su número atómico (Z) es 1.
- Electrón: Se encuentra en la corteza. Su masa aproximadamente es de 9,1×10-31 kg. Tiene carga eléctrica negativa (-1.602×10-19 C).[1]
- Neutrón: Se encuentra en el núcleo. Su masa es casi igual que la del protón. No posee carga eléctrica.
3. Enlace químico
¿Qué es un enlace químico?
Conocemos como enlaces químicos a la fusión de átomos y moléculas para formar compuestos químicos más grandes y complejos dotados de estabilidad. En este proceso los átomos o moléculas alteran sus propiedades físicas y químicas, constituyendo nuevas sustancias homogéneas (no mezclas), inseparables a través de mecanismos físicos como el filtrado o el tamizado.
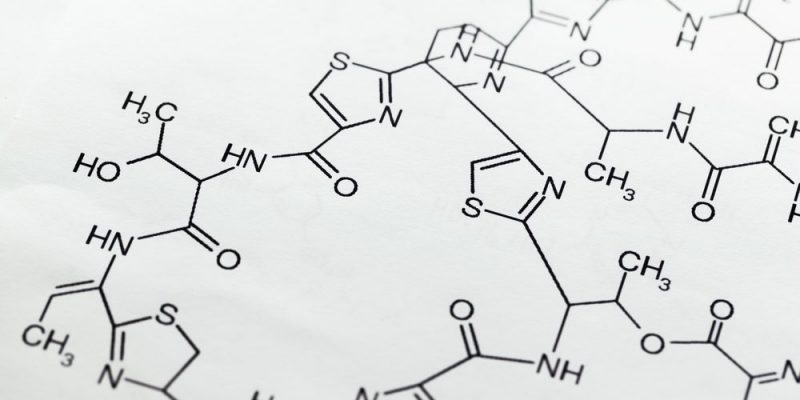
Es un hecho que los átomos que forman la materia tienden a unirse y alcanzar condiciones más estables que en solitario, a través de diversos métodos que equilibran o comparten sus cargas eléctricas naturales. Se sabe que los protones en el núcleo de todo átomo poseen carga positiva (+) y los electronesalrededor poseen carga negativa (-), mientras que los neutrones, también en el núcleo, no tienen carga, pero aportan masa (y, por lo tanto, gravedad).
Los enlaces químicos ocurren en la naturaleza y forman parte tanto de sustancias inorgánicas como de formas de vida, ya que sin ellos no podrían construirse las proteínas y aminoácidos complejos que conforman nuestros cuerpos.
De manera semejante, los enlaces químicos pueden romperse bajo ciertas y determinadas condiciones, como al ser sometidos a cantidades de calor, a la acción de la electricidad, o a la de sustancias que rompan la unión existente y propicien otras nuevas junturas.
Así, por ejemplo, es posible someter al agua a electricidad para separar las uniones químicas entre el hidrógeno y el oxígeno que la conforman, en un proceso denominado electrólisis; o añadir grandes cantidades de energía calórica a una proteína para romper sus enlaces y desnaturalizarla, es decir, romperla en trozos más pequeños.
Tipos de enlace químicoExisten tres tipos de enlace químico conocidos, dependiendo de la naturaleza de los átomos involucrados, así:
- Enlace covalente. Ocurre entre átomos no metálicos y de cargas electromagnéticas semejantes (por lo general altas), que se juntan y comparten algunos pares de electrones de su última órbita (la más externa), y conseguir una forma eléctrica más estable. Es el tipo de enlace predominante en las moléculas orgánicas y puede ser de tres tipos: simple (A-A), doble (A=A) y triple (A≡A), dependiendo de la cantidad de electrones compartidos.
- Enlace iónico. Tiene lugar entre átomos metálicos y no metálicos, y consiste en una transferencia permanente de electrones desde el átomo metálico hacia el átomo no metálico, produciendo una molécula cargada eléctricamente en algún sentido, ya sea cationes (+1) o aniones (-1).
- Enlace metálico. Se da únicamente entre átomos metálicos de un mismo elemento, que por lo general constituyen estructuras sólidas, sumamente compactas. Es un enlace fuerte, que junta los núcleos atómicos entre sí, rodeados de sus electrones como en una nube, y cuesta mucho esfuerzo separarlos.
Ejemplos de enlace químico
Algunos ejemplos de enlace covalente están presentes en los siguientes compuestos:
- Benceno (C6H6)
- Metano (CH4)
- Glucosa (C6H12O6)
- Amoníaco (NH3)
- Freón (CFC)
- En todas las formas del carbono (C): carbón, diamantes, grafeno, etc.
En cambio, ejemplos de compuestos con enlaces iónicos son:
- Óxido de magnesio (MgO)
- Sulfato de cobre (CuSO4)
- Ioduro de potasio (KI)
- Cloruro de manganeso (MnCl2)
- Carbonato de calcio (CaCO3)
- Sulfuro de hierro (Fe2S3)
Y, finalmente, ejemplos de elementos con enlaces metálicos:
- Barras de hierro (Fe)
- Yacimientos de cobre (Cu)
- Barras de oro puro (Au)
- Barras de plata pura (Ag)
Fuente: https://concepto.de/enlace-quimico/#ixzz5yNVOYM2A
3.1. QUÍMICA. Tipos de enlaces químicos: iónico, covalente y metálico
4. Regla del octeto
La regla de octeto o regla del octeto es una regla que se emplea en el contexto de la química. La regla del octeto define la propiedad que tienen los átomos de completar su último nivel de energía con ocho electrones para alcanzar estabilidad. Ya sea un enlace iónico, covalente o metálico, los átomos van a tender a ceder o compartir para completar 8 electrones en la capa de valencia.
El creador de esta regla es el científico Gilbert Newton Lewis y fue creada en 1917.
La base de esta regla son los gases nobles que tienen 8 electrones en su última capa y son los elementos menos reactivos de toda la tabla periódica. Lewis advirtió que al unirse diferentes iones entre sí, quieren lograr la configuración de un gas noble, consiguiendo 8 electrones en su última capa.
Esta regla se aplica en la creación de enlaces químicos entre los átomos. El comportamiento y las propiedades de las moléculas dependerán del tipo de enlace, número de enlaces por átomo y de las fuerzas intermoleculares.
Existen diferentes tipos de enlace químico, según la electronegatividad de los elementos. En cualquiera de los enlaces, los átomos tienden a roadearse de 8 electrones en la capa más externa.
- enlace iónico.
- enlace covalente.
- enlace metálico.
La mejor forma para ver de forma gráfica cómo funciona la “regla del octeto” es la representación de Lewis de las moléculas. Antes de escribir la representación de la estructura de Lewis hay que conocer cómo están unidos los átomos de verdad, ya que muchas veces la fórmula no representa las uniones entre átomos. Por ejemplo aunque la fórmula del ácido nítrico con frecuencia se representa como HNO3, en realidad el hidrógeno está unido a un oxígeno, no al nitrógeno. La estructura es HONO2 y no HNO3.
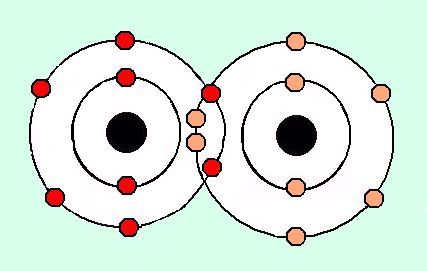
EXCEPCIONES REGLA DEL OCTETO
- El hidrógeno al tener un único orbital en su capa de valencia la cual puede aceptar como máximo dos electrones.
- El berilio se completa en su última capa con cuatro electrones.
- El boro que requiere de seis electrones para llevar a cabo esta función.
- El aluminio. El aluminio consigue la estabilidad con 6 electrones en su capa de valencia.
4.1. Estructuras de Lewis y regla del octeto
4.2. Regla del Octeto
5. Estructura de Lewis
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis, representación de Lewis o fórmula de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante, estable y relativa. En esta fórmula se muestran enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente indicando la ordenación de los átomos en el espacio. Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y después de cada uno de estos se encuentran en cada enlace covalente.
Las estructuras de Lewis muestran los diferentes átomos de una determinada causa usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. Representan también si entre los átomos existen enlaces simples, dobles o triples. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones apartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
Este modelo fue propuesto por Gilbert Newton Lewis quién lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
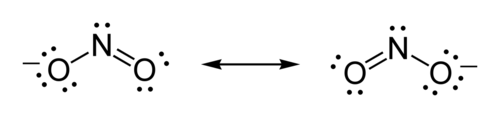
Ejemplo: Estructura de Lewis para el ion nitrito
La fórmula del ion de nitrito es :NO2-
- Paso uno: Escoger el átomo central. Existe sólo un átomo de nitrógeno, y es el átomo con más electronegatividad, por lo que éste se convertirá en nuestro átomo central.
- Paso dos: Contar los electrones de valencia. El nitrógeno posee 5 electrones de valencia; cada oxígeno posee 6, para un total de (6 × 2) + 5 = 17. El ion posee una carga de –1, lo que nos indica un electrón extra, por lo que el número total de electrones es de 18.
- Paso tres: Ubicar los pares electrónicos. Cada oxígeno debe ser enlazado al nitrógeno, que usa cuatro electrones, dos en cada enlace. Los 14 electrones restantes deben ser ubicados inicialmente como 7 pares solitarios. Cada oxígeno debe tomar un máximo de 3 pares solitarios, dándole a cada oxígeno 8 electrones, incluyendo el par del enlace. El séptimo par solitario debe ser ubicado en el átomo de nitrógeno.
- Paso cuatro: Cumplir la regla del octeto. Ambos átomos de oxígeno poseen 8 electrones asignados a ellos. El átomo de nitrógeno posee sólo 6 electrones asignados. Uno de los pares solitarios de uno de manera simple con el átomo de nitrógeno. Ponga los corchetes alrededor de cada estructura, y escriba la carga ( - ) en el rincón superior derecho afuera de los corchetes. Dibuje una flecha doble entre las dos formas de resonancia.
5.1. QUÍMICA. Estructuras de Lewis
5.2. ESTRUCTURA DE LEWIS Y REGLA DEL OCTETO | Química básica
6. Tipos de enlaces entre átomos: enlace iónico, enlace covalente, enlace metálico
6.1. COMO IDENTIFICAR TIPOS DE ENLACE | Química Básica