REACCIONES QUÍMICAS DE COMPUESTOS BINARIOS INORGÁNICOS DE USO TECNOLÓGICO E INDUSTRIAL
| Sitio: | ue.aprendiendomas.com.bo |
| Curso: | 2° - Ciencias Naturales |
| Libro: | REACCIONES QUÍMICAS DE COMPUESTOS BINARIOS INORGÁNICOS DE USO TECNOLÓGICO E INDUSTRIAL |
| Impreso por: | Invitado |
| Fecha: | lunes, 7 de abril de 2025, 07:44 |
1. Reacciones de óxidos y anhídridos de interés industrial
Óxidos
El Oxido es un compuesto inorgánico que se forma al unir algún elemento químico con Oxígeno. Los óxidos se clasifican en dos grupos: Óxidos Básicos y Óxidos Ácidos.
Los óxidos son compuestos binarios formados por la combinación del oxígeno con un elemento químico.
El oxígeno actúa con su número de oxidación (-2), mientras el otro elemento actúa con un número de oxidación positivo.

La fórmula se obtiene al intercambiar las valencias de dichos elementos.
X2OnDonde:
- X, es cualquier elemento químico
- n, es la valencia de dicho compuesto químico
Ejemplos:
- Fe2O3 Oxido con Hierro de valencia 3
- FeO Oxido con Hierro de valencia 2
Ahora considerando el FeO, si es Hierro con valencia 2 el compuesto sería Fe2O2, pero los compuestos siempre hay que simplificarlos, así que se queda en FeO.
Un Óxido es básico si el elemento químico que se junta con el Oxígeno (O) es un metal.
Un Óxido es Ácido si el elemento químico que se junta con el oxígeno es un no metal.
NOMENCLATURA:
Las nomenclaturas más utilizadas son la estequiométrica y la de Stock, aunque tambien existe la tradicional pero está en desuso.
Estequiométrica o sistemática:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido precedido de el prefijo numérico que le corresponde, debido a la cantidad de átomos que hay en el compuesto de dicho elemento, y para el elemento, su nombre precedido tambien por el prefijo numérico que le corresponde, unidos los 2 elementos por la particula "de".
Los prefijos son:
- Mono
- Di
- Tri
- Tetra
- Penta
- Hexa
- Hepta
- Octa
- Nona
- Deca
Ejemplos:
- Fe2O3 Trioxido de dihierro.
- FeO Óxido de hierro
STOCK:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido, pero no se le precede de ningún prefijo, después se sitúa la partícula "de" y a continuación de pone el nombre del elemento, seguido, si es necesario, de su valencia en números romanos. Si dicho elemento no tiene más que una sola valencia, no es necesario ponerlo.
Ejemplos:
- Fe2O3 Óxido de hierro (III)
- FeO Oxido de hierro (II)
- Na2O Oxido de sodio
Excepción: El oxígeno no forma óxido con el fluor, ya que éste es más electronegativo.
Tradicional:
En esta forma de nomenclatura consideramos sufijos prefijos que dependen de la cantidad de valencias que tenga el elemento con el que se forma el óxido.
| Prefijo | Sufijo | Cantidad Valencias | ||
|---|---|---|---|---|
| Hipo | 3 | 4 | ||
| Oso | 2 | |||
| Ico | ||||
| Per | Ico | |||
Si es un oxido básico usamos la palabra Óxido seguido del prefijo, luego el nombre del elemento y terminamos con el sufijo.
Ejemplo: Para el cromo Cr que tiene valencias +2, +3, +6 tenemos:
CrO Óxido hipocromoso
Cr2O3 Óxido cromoso
CrO3 Óxido crómico
Para un oxido ácido usamos la palabra anhídrido en lugar de la palabra óxido
Ejemplo: Para el azufre S que tiene valencias +2, +4, +6 tenemos
SO Anhídrido hiposulfuroso
SO2 Anhídrido Sulfuroso
S2O3 Anhídrido Sulfúrico
¿Cómo formamos un Óxido?
En primer lugar se busca cualquier elemento. Por ejemplo tomemos el Hierro (Fe).
Una vez que se escoge el elemento, este se escribe junto al oxígeno Fe O. Luego asignamos las valencias a los elementos, para el oxígeno es -2 y para el hierro al revisar en la tabla periódica vemos que tiene el +2 y +3. Usemos en este caso el +3, nos quedaría de esta forma Fe+3 O-2 , luego aplicando la conocida regla del aspa, que consiste en intercambiar las valencias (estado o número de oxidación) asignamos la del oxígeno al hierro y la del hierro al oxigeno pero en forma de subíndices y sin su signo, quedando de la siguiente forma Fe2O3.
Nota: Acuérdate que varios elementos poseen más de una valencia, así que ten a la mano la tabla periódica y trata de aprenderte las que mas puedas.
Su usamos la valencia +2 para el hierro la fórmula nos quedaría así : Fe2O2 la cual se puede simplificar, entonces en nuestro caso nos queda: FeO.
AnhídridosLos anhídridos son compuestos formados por un elemento no metálico más oxígeno. Este grupo de compuestos son también llamados óxidos ácidos u óxidos no metálicos.
Formulación de los anhídridos (óxidos ácidos o no metálicos)
Los anhídridos son formulados utilizando el símbolo del elemento no metálico junto a la valencia del oxígeno más el oxígeno junto a la valencia del elemento no metálico.
La fórmula de los anhídridos es del tipo X2On (donde X es un elemento no metálico y O es oxígeno). Entre los numerosos ejemplos de los anhídridos se encuentran: CO2, SO3, SeO, etc.
Nomenclatura de los anhídridos (óxidos ácidos o no metálicos)
Nomenclatura tradicional: la nomenclatura tradicional de los anhídridos se realiza nombrando la palabra anhídrido seguido del elemento no metálico. Para ello se debe de tener en cuenta la valencia del elemento no metálico siguiendo los siguientes criterios:
- Una valencia: Anhídrido ... ico
- Si+4 + O-2 » Si2O4 » SiO2: anhídrido silícico
- Dos valencias:
- Menor valencia: Anhídrido ... oso
- C+2 + O-2 » C2O2 » CO: anhídrido carbonoso
- Mayor valencia: Anhídrido ... ico
- C+4 + O-2 » C2O4 » CO2: anhídrido carbónico
- Menor valencia: Anhídrido ... oso
- Tres valencias:
- Menor valencia: Anhídrido hipo ... oso
- S+2 + O-2 » S2O2 » SO: anhídrido hiposulfuroso
- Valencia intermedia: Anhídrido ... oso
- S+4 + O-2 » S2O4 » SO2: anhídrido sulfuroso
- Mayor valencia: Anhídrido ... ico
- S+6 + O-2 » S2O6 » SO3: anhídrido sulfúrico
- Menor valencia: Anhídrido hipo ... oso
- Cuatro valencias:
- Primera valencia (baja): Anhídrido hipo ... oso
- I+1 + O-2 » I2O: anhídrido hipoyodoso
- Segunda valencia: Anhídrido ... oso
- I+3 + O-2 » I2O3: anhídrido yodoso
- Tercera valencia: Anhídrido ... ico
- I+5 + O-2 » I2O5: anhídrido yódico
- Cuarta valencia (alta): Anhídrido per ... ico
- I+7 + O-2 » I2O7: anhídrido peryódico
- Primera valencia (baja): Anhídrido hipo ... oso
Nomenclatura de stock: la nomenclatura de stock consiste en escribir la palabra "óxido" + elemento no metálico y a continuación el número de valencia del elemento no metálico en números romanos y entre paréntesis.
Ejemplos:
CO2: óxido de carbono (IV)
Br2O3: óxido de bromo (III)
Nomenclatura sistemática: la nomenclatura sistemática consiste en la utilización de un prefijo que depende del número de átomos de cada elemento seguido de la expresión "óxido" + el elemento no metálico precedido de la valencia del elemento no metálico.
Los prefijos utilizados dependiendo del número de átomos en esta nomenclatura son:
- 1 átomo: Mono
- 2 átomos: Di
- 3 átomos: Tri
- 4 átomos: Tetra
- 5 átomos: Penta
- 6 átomos: Hexa
- 7 átomos: Hepta
Ejemplos:
P2O5: pentaóxido de difósforo
Cl2O: monóxido de dicloro
2. Nomenclatura, usos y aplicaciones de los óxidos y anhídridos
Nomenclatura Óxidos
Nomenclatura tradicional
Para nombrar correctamente el óxido metálico de acuerdo a las normas regidas por la IUPAC, es necesario conocer las posibles valencias del metal M. A la mayor (la más positiva) se le asigna al nombre del metal el sufijo –ico, mientras que a la menor, el prefijo –oso.
Ejemplo: dadas las valencias +2 y +4 del metal M, sus óxidos correspondientes son MO y MO2. Si M fuera el plomo, Pb, entonces PbO sería óxido plumboso, y PbO2 el óxido plúmbico. Si el metal tiene una sola valencia, se le nombra su óxido con el sufijo –ico. Así, Na2O es el óxido sódico.
Por otro lado, los prefijos hipo- y per- se agregan cuando hay tres o cuatro valencias disponibles para el metal. De esta manera, el Mn2O7 es el óxido permangánico, debido a que el Mn tiene valencia +7, la mayor de todas.
No obstante, este tipo de nomenclatura presenta ciertas dificultades y suele ser la menos utilizada.
Nomenclatura sistemática
En ella se consideran el número de átomos de M y oxígeno que conforman la fórmula química del óxido. A partir de ellos, se le asigna los correspondientes prefijos mono-, di-, tri-, tetra-, etc.
Tomando como ejemplo los tres óxidos metálicos recientes, el PbO es el monóxido de plomo; el PbO2 el dióxido de plomo; y el Na2O el monóxido de disodio. Para el caso de la herrumbre, Fe2O3, su nombre respectivo es el trióxido de dihierro.
Nomenclatura stock
A diferencia de las otras dos nomenclaturas, en esta tiene mayor importancia la valencia del metal. La valencia se especifica mediante números romanos entre paréntesis: (I), (II), (III), (IV), etc. El óxido metálico se nombra entonces como óxido de metal .
Aplicando la nomenclatura stock para los ejemplos anteriores se tiene:
-PbO: óxido de plomo (II).
-PbO2: óxido de plomo (IV).
-Na2O: óxido de sodio. Como tiene valencia única de +1, no se especifica.
-Fe2O3: óxido de hierro (III).
-Mn2O7: óxido de manganeso (VII).
- Tienen un elevado punto de fusión.
- Son compuestos binarios que también son llamados óxidos básicos.
- Reaccionan con el agua y forman hidróxidos.
- Se presentan en los tres estados de agregación.
- En este caso el oxígeno trabaja con su valencia de -2.
- Son buenos conductores de la electricidad y el calor.
Usos en la vida cotidiana
El óxido de magnesio se utiliza en la preparación de medicamentos contra la acidez estomacal. También como antídoto para muchos tipos de intoxicaciones.
El óxido de zinc se emplea para la fabricación de pinturas y colorantes.

El óxido de aluminio se emplea para trabajar metales y aleaciones de gran dureza.


Anhidridos
Nomenclatura tradicional: En lo anhídridos se aplica de la siguiente forma, se coloca de primer lugar la palabra Anhídrido y después el nombre del elemento No Metálico y se requiere saber y tener en claro la valencia del no metal según estos criterios
- Una valencia Terminación “ico”
- Dos valencias Terminación “oso” menor valencia y mayor “ico”
- Tres valencias Terminación “Hipo..oso” (en la 1), “oso” (en la 2), “ico” (en la 3).
- Cuatro valencias Terminación “Per..ico” (en la 4)
Nomenclatura stock
Se coloca de primero la palabra Óxido seguido de el elemento No Metálico y por último el número de valencia del no metal en número romanos y entre paréntesis. Ejemplo: Óxido de Carbono (IV)
Nomenclatura sistemática
Consiste en colocarle un prefijo a la expresión Óxido pero dependiendo del número de átomos de cada elemento y después se coloca el elemento No Metálico precedido de la valencia del no metal.
Según los átomos son:
- MONO.
- DI.
- TRI.
- TETRA.
- PENTA.
- HEXA.
- HEPTA.
Los anhídridos u óxidos no metálicos tienen múltiples usos y aplicaciones en la vida cotidiana solo que se utilizan con nombres vulgares que constantemente están en nuestro entorno pero por no saber sus nombres científicos no llegamos a reconocerlos por ejemplo:
- El anhídrido Carbónico, que es mayormente conocido como Dióxido de Carbono el CO2, es un gas que tiene un montón de propiedades que lo hacen perfecto para extinción de cualquier incendio.
- El anhídrido Sulfuroso, se utiliza como un conservante y antioxidante el cual se halla en los frutos secos que nos gusta consumir en mermeladas, jugos artificiales y en el vino. SO2
- El anhídrido Silícico SiO2, se manipula y utiliza como un abrasivo para la realización de discos, la fabricación de lijas y hasta bloques.
- El anhídrido Bórico B2O3, se utiliza en la medicina, para crear productos insecticidas, en la energía nuclear se encuentra, para conservación, en la pirotecnia, entre otros.
- El anhídrido Brómico Br2O5, los bromuros intervienen evidentemente en la medicina como sedantes, específicamente el bromuro de plata se maneja como dispositivo fundamental para las placas fotográficas que te crean cuando te fracturas un hueso.
- El anhídrido Etanoico o Acético, está relacionado con la fabricación de acetato de celulosa, de resinas, también en la síntesis de aspirinas, entre otros.
3. Reacciones de hidruros de interés industrial, manejo adecuado de residuos industriales
La combinación de cualquier elemento con hidrógeno es conocido con el nombre de hidruro. Dado que el hidrógeno es un componente tan común de muchos materiales, podemos ver hidrurosprácticamente en todas partes. El agua tiene un enlace oxígeno-hidrógeno, por lo que es un hidruro. Los alimentos tienen enlaces carbono-hidrógeno, por lo tanto son catalogados también como hidruro y muchos de los objetos que vemos en nuestras vidas también tendrán enlaces carbono-hidrógeno que incluyen plástico, ropa, paredes de madera y muchos otros compuestos.Los hidruros son un tipo de compuestos químicos que combinan en su molécula átomos de hidrógeno y átomos de cualquier otro elemento que se encuentra dentro de la tabla periódica. Es la combinación del hidrógeno con otro elemento.
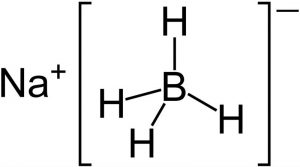
Tipos de hidruros
Existen tres tipos de hidruros que son:
- Hidruros metálicos: se forman por elementos alcalinos y alcalino-térreos. Son compuestos no volátiles que tienen conductividad. En este grupo se puede distinguir a los hidruros que forman los metales más electropositivos y son llamados hidruros salinos que por lo general son sólidos blancos o grises que se obtienen por reacción directa del metal con hidrógeno a altas temperaturas.
- Los hidruros volátiles o no metálicos: se forman con elementos no metálicos con poca electronegatividad, esto quiere decir con nitrógeno, fósforo, arsénico, antimonio, bismuto, boro, carbono y silicio. Se conocen también como hidruros moleculares o covalentes, porque tienen enlaces covalentes.
- Los hidruros hidrácidos: nacen de la combinación del hidrógeno con un halógeno o bien con un elemento anfígeno.
Características
Las principales características que poseen los hidruros son las siguientes:
- Todos son térmicamente inestables y algunos explotan al contacto con el aire o la humedad.
- En los hidruros metálicos el número de oxidación es de -1.
- En los hidruros no metálicos el número de oxidación del hidrógeno es 1.
- Dependiendo de la clase de elemento con el que se combina, el hidrógeno de los hidruros puede formar enlaces iónicos o covalentes.
- La nomenclatura tradicional de los hidruros metálicos se hace nombrando la palabra hidruro seguido del elemento metálico.
- Son catalogados como compuestos inorgánicos binarios porque tienen dos elementos químicos.
Por lo general los hidruros son compuestos estequiométricos que presentan propiedades metálicas como por ejemplo la conductividad. Tienen una gran velocidad de difusión del hidrógeno por medio del sólido cuando se someten a temperatura elevadas.
Los hidruros salinos por lo general se encuentran en estado sólido y son de color blanco o gris. Este tipo de hidruro se puede obtener por medio de reacciones directas del metal con el hidrógeno.
Elementos como el fósforo, arsénico y sus compuestos son considerados tóxicos. Tienen agentes reductores bastante efectivos y no reaccionan con el agua o con los ácidos catalogados como no oxidantes.
Cómo se forman los hidrurosLos hidruros son un compuesto que se forman cuando una molécula de hidrógeno se une a cualquier otro elemento de la tabla periódica. Cuando el compuesto químico se compone de un hidrógeno y un metal, será entonces un hidruro metálico y si se combina con un elemento que no es un metal, se lo nombra como hidruro no metálico.
El hidrógeno forma enlaces de tipo covalente o iónico, dependiendo del elemento con el que se combine. Cuando se asocia con metales de transición, se forman los hidruros intersticiales con propiedades físicas y químicas que pueden variar enormemente de un metal a otro.
MANEJO DE RESIDUOS INDUSTRIALES
No es ningún secreto que nuestro ecosistema está en constante peligro debido a nuestras acciones poco ecológicas. Aunque el impacto lo hacemos todos, el daño que un individuo puede causar no se compara con el de una industria. Las fábricas y plantas de energía producen enormes cantidades de residuos industriales que deben clasificarse, separarse y desecharse de la manera correcta y en los lugares designados. Sin embargo, acumular la basura “fuera de nuestra vista” nos ha demostrado que no es la mejor solución a largo plazo.

Como seres humanos, estamos acostumbrados a colocar todo lo que nos molesta, agobia o entristece, fuera de nuestra vista. En muchos aspectos de tu vida creo que sabes que hacerte de la vista gorda, al final, no resulta en nada bueno. Con los residuos industriales no es nada diferente, es mucho peor.
Desde hace algunos años ya, la humanidad ha hecho conciencia del impacto que tiene en el medio ambiente en mal manejo de los residuos. Más allá de los residuos domésticos, los residuos industriales son los que preocupan, pues sus cantidades son alarmantes y muchos de esos materiales son altamente tóxicos.
En la industria, muchos de los residuos que se generan van más allá del conocimiento general. Todos conocemos el escombro como un residuo de la construcción, no parece un material muy peligroso sin embargo muchos hemos sido testigos de a dónde va a parar y muchas veces no es tan lejos de nuestras propias casas. Un montón de rocas, cemento y tierra puede no parecer muy alarmante, se considera contaminación visual, pero no se compara con la contaminación que pueden causar los residuos tóxicos, químicos y radiactivos.
¿Qué pasa con todos los residuos?
La mayoría de los residuos no peligrosos, como el escombro, son tratados como la mayoría de la basura que generas. Si bien, no es la mejor manera, no representan un peligro inmediato y es por ello que usualmente van a parar a los vertederos.
Enormes cantidades de plástico, papel, cartón, entre otros, son acumulados a gran escala junto con el resto de tu basura; sin embargo la conciencia ambiental ha logrado que hayan surgido empresas comprometidas con la Cultura del Reciclaje. No son sólo empresas comprometidas a reciclar sus propios residuos, sino también empresas dedicadas especialmente al reciclaje de residuos.
Aunque sea muy bonito reciclar, no todos los materiales pueden reutilizarse, existen residuos demasiado peligrosos, hasta para voltear a verlos.
Para saber cómo se manejan los residuos, primero debes saber cuáles son sus tipos y como se clasifican.
TIPOS DE RESIDUOS INDUSTRIALES
De acuerdo a la ley, un residuo industrial es aquel resultante de los procesos de fabricación, transformación, utilización, consumo, limpieza o mantenimiento generado por la actividad industrial. Se excluyen las emisiones atmosféricas.
Hay dos principales tipos de residuos industriales: Inertes y Peligrosos. Los residuos inertes son aquellos como el escombro, que hacen que tu colonia se vea del tercer mundo. Los residuos peligrosos son aquellos que, como su nombre lo indica, generan un peligro para la salud humana, las plantas, animales y medio ambiente en general.
Los residuos inertes son usualmente materiales sencillos de reciclar, por ejemplo, el escombro puede utilizarse para nuevas construcciones, no se diga más del plástico, papel y cartón, pero el reciclaje tiene un costo y muchas empresas aún no tienen los recursos o el interés de llevarlo a cabo.
Debido a que los materiales reciclados han probado ser un negocio rentable, muchas empresas se encargan de recolectar estos residuos directamente de las industrias y con ellos dar inicio a un ciclo de reciclaje que ha probado minimizar el impacto ambiental.
Pero ¿Qué pasa con los residuos peligrosos?
Bueno, no todos los residuos peligrosos son tratados como tal. Muchos de ellos terminan en los mismos vertederos de basura donde tardarán miles de años en degradarse y desaparecer, no sin antes haber generado un buen impacto ambiental, como un gato de tres ojos o algo por el estilo.
Dado que los residuos peligrosos pueden ser tan diversos, se busca la mejor manera de reutilizarlos, si bien no pueden usarse de la misma manera que para la que fueron creados (como los residuos inertes), se trata de darles un uso alterno. Por ejemplo, el aceite de cocina quemado se puede procesar y reutilizar como biodiesel.
Algunos de los residuos peligrosos se clasifican de la siguiente manera:
Explosivos: materiales que son sensibles a explotar debido al cambio de temperaturas, fricción y/o choques.
Inflamables: como su nombre lo dice, que tienden a ser fáciles de prenderse fuego como un ateo en misa.
Tóxico: son materiales parecidos a los nocivos, pero en mucho mayor grado y que pueden causar la muerte.
Corrosivos: pueden destruir materiales y tejidos vivos al entrar en contacto.
Biológicos: se refiere a todos los residuos relacionados a tejidos vegetales o animales, microorganismos y toxinas. Por ejemplo, aquello de lo que te despides cuando bajas la cadena del retrete.
REUTILIZACIÓN Y RECICLAJE
Muchos de los residuos industriales pueden reciclarse, la mayoría de ellos pertenecen a los residuos inertes, pues ellos no representan un peligro para el medio ambiente. Por ejemplo el plástico, el papel y el cartón, su proceso de reciclaje es más sencillo.
Los residuos peligrosos, sin embargo, requieren de una atención más especializada, empezando por su transportación y almacenaje. Los contenedores y la manera en que estos son transportados, deben cumplir con una larga lista de normativas que regulan la seguridad de todo el proceso de transportación.
De la misma manera, no es tan fácil reutilizar un residuo peligroso, existen distintos tipos de tratamientos que se llevan a cabo para volver a darle un uso a esos materiales.
Tipos de Tratamientos
El tratamiento que se le da a un material peligroso para su reutilización, si bien no lleva al producto a cumplir la misma función una y otra vez como el plástico y el papel, al menos le da otra función en un ámbito industrial diferente. Existen 4 tipos de tratamientos:
Mecánicos: sencillos, como la reutilización de licuadoras y planchas para reciclar papel.
Químicos: se lleva a cabo un proceso químico a través del cual se eliminan y añaden elementos que lo convierten en un producto útil como el aceite usado en biodiesel.
Biológicos: un proceso muy conocido es el de la creación de composta a base de residuos orgánicos como la comida, o la de fertilizantes a base de los desechos de los animales.
Térmicos: el más conocido de ellos es el del plástico. Se derrite el plástico a altas temperaturas para volver a ser utilizado.
En la industria, el manejo de residuos implica un costo considerable dentro del proceso de producción de un bien o un servicio. Desde la transportación y el almacenamiento, hasta la posible reutilización del mismo. Sin embargo, el buen manejo de un material que ha sido desechado y puede ser reutilizado tiene un impacto positivo para todos, para nuestro medio ambiente y para el bolsillo también. El buen manejo de los residuos es una cuestión de cultura y educación, cuanto más sepamos de qué otro uso le podemos dar a los residuos, mejor podremos aplicar esas prácticas para nuestro beneficio.
4. Nomenclatura, usos y aplicaciones de los hidruros
Nomenclatura de los Hidruros
Los hidruros se forman cuando un elemento metálico combina con el gas hidrógeno y éste reacciona. La ecuación general para los mismos es la siguiente:
Me + H2 → MeHx
En donde:
- X = es el número de oxidación del metal.
Es importante recordar que el número de oxidación del hidrógeno en los hidruros siempre va a ser de -1.
Usos y aplicacionesAlgunos de los usos de los hidruros los podemos mencionar a continuación:
- Funcionan como desecantes y reductores, y algunos se utilizan como fuentes de hidrógeno puro.
- Baterías de níquel metal hidruro que son recargables y de uso tanto doméstico como industrial.
- Algunos de ellos pueden ser usados en limpieza, para desteñir cabellos y en lavandería.
- Son usados como plaguicidas en fumigación, pero este uso es restringido para comercios.
- Aplicaciones técnica como por ejemplo la creación de abonos, explosivos, colorantes de plásticos, fibras textiles, pinturas, y pilas.
- Algunos funcionan en la síntesis de los compuestos orgánicos e inorgánicos del yodo.
- En el área de la medicina también pueden algunos de ellos ser usados como suplementos.