SUSTANCIAS NITROGENADAS ORGÁNICAS, ÉSTERES, SALES ORGÁNICAS Y LAS BIOMOLÉCULAS DE USO INDUSTRIAL Y NUTRICIONAL.
3. Propiedades, preparación y usos de las sales orgánicas (saponificación)
Sales orgánicas: propiedades, usos
Las sales orgánicas son un denso número de compuestos iónicos con innumerables características. Derivan previamente de un compuesto orgánico, el cual ha sufrido una transformación que le permite ser portador de una carga, y que además, su identidad química depende del ion asociado.
En la imagen inferior se muestran dos fórmulas químicas muy generales para las sales orgánicas. La primera de ellas, R-AX, se interpreta como un compuesto en cuya estructura carbonada un átomo, o grupo A, porta una carga positiva + o negativa (-).
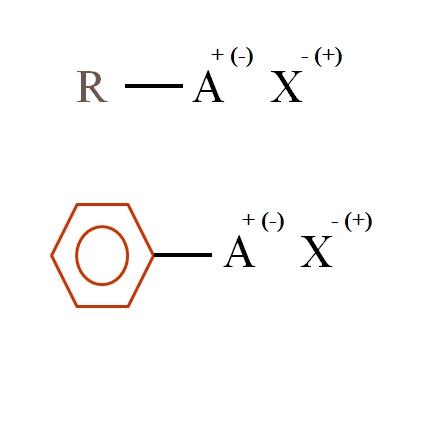
Como puede apreciarse, existe un enlace covalente entre R y A, R-A, pero a su vez, A tiene una carga formal que atrae (o repele) al ion X. El signo de la carga dependerá de la naturaleza de A y del entorno químico.
Si A fuera positiva, ¿con cuántos X podría interactuar? Con uno solo, dado el principio de electroneutralidad (+1-1=0). Sin embargo, ¿cuál es la identidad de X? El anión X podría ser el CO32–, requiriendo de dos cationes RA+; un halogenuro: F–, Cl–, Br–, etc.; o incluso, otro compuesto RA–. Las opciones son incalculables.
Asimismo, una sal orgánica puede tener carácter aromático, ilustrado en el anillo bencénico de color marrón. La sal benzoato de cobre (II), (C6H5COO)2Cu, por ejemplo, consiste en dos anillos aromáticos con grupos carboxilos cargados negativamente, los cuales interactúan con el catión Cu2+.
Propiedades físicas y químicas
De la imagen se puede afirmar que las sales orgánicas constan de tres componentes: el orgánico, R o Ar (el anillo aromático), un átomo o grupo portador de la carga iónica A, y un contraión X.
Así como la identidad y estructura química vienen definidas por tales componentes, del mismo modo sus propiedades dependen de ellos.
A partir de este hecho se pueden resumir ciertas propiedades generales que cumplen la gran mayoría de estas sales.
Masas moleculares altas
Asumiendo aniones X inorgánicos mono o polivalentes, las sales orgánicas suelen tener masas moleculares mucho más grandes que las sales inorgánicas. Esto se debe principalmente al esqueleto carbonado, cuyos enlaces simples C-C, y sus átomos de hidrógenos, aportan mucha masa al compuesto.
Por lo tanto, son R o Ar los responsables de sus altas masas moleculares.
Anfifílicos y surfactantes
Las sales orgánicas son compuestos anfifílicos, es decir, sus estructuras poseen tanto extremos hidrofílicos como hidrofóbicos.
¿Cuáles son tales extremos? R o Ar representan el extremo hidrofóbicos, debido a que sus átomos de C y H no tienen gran afinidad por las moléculas de agua.
A+(-), el átomo o grupo portador de la carga, es el extremo hidrofílico, ya que contribuye al momento dipolar e interactúa con el agua formando dipolos (RA+ OH2).
Cuando las regiones hidrofílicas e hidrofóbicas se encuentran polarizadas, la sal anfifílica se convierte en un surfactante, sustancia ampliamente utilizada para la elaboración de detergentes y desemulsificantes.
Puntos de ebullición o fusión altos
Al igual que las sales inorgánicas, las sales orgánicas tienen también altos puntos de fusión y ebullición, debido a las fuerzas electrostáticas que gobiernan en fase líquida o sólida.
Sin embargo, al haber un componente orgánico R o Ar, participan otros tipos de fuerzas de Van der Waals (fuerzas de London, dipolo-dipolo, puentes de hidrógeno) que compiten de cierto modo con las electrostáticas.
Por esta razón, las estructuras sólidas o líquidas de las sales orgánicas son, en primera instancia, más complejas y variadas. Algunas de ellas inclusive pueden comportarse como cristales líquidos.
Acidez y basicidad
Las sales orgánicas por lo general son ácidos o bases más fuertes que las sales inorgánicas. Esto se debe a que A, por ejemplo en las sales de amina, posee una carga positiva debido a su enlace con un hidrógeno adicional: A+-H. Entonces, en contacto con una base, dona el protón para volver a ser un compuesto neutro:
RA+H + B => RA + HB
El H pertenece a A, pero se escribe ya que interviene en la reacción de neutralización.
Por otro lado, RA+ puede tratarse de una molécula grande, incapaz de formar sólidos con una red cristalina lo suficiente estable con el anión hidroxilo u oxhidrilo OH–.
Cuando esto es así, la sal RA+OH– se comporta como una base fuerte; incluso tan básica como el NaOH o el KOH:
RA+OH– + HCl => RACl + H2O
Nótese en la ecuación química que el anión Cl– sustituye al OH–, formando la sal RA+Cl–.
Usos
El uso de las sales orgánicas variará de acuerdo a la identidad de R, Ar, A y X. Más aún, la aplicación a que se destinen también depende del tipo de sólido o líquido que forman. Algunas generalidades al respecto son:
-Sirven como reactivos para la síntesis de otros compuestos orgánicos. RAX puede actuar como un “dador” de la cadena R para que se adicione a otro compuesto sustituyendo a un buen grupo saliente.
-Son surfactantes, por lo que también pueden utilizarse como lubricantes. Las sales metálicas de carboxilatos se usan para este propósito.
-Permiten sintetizar una amplia gama de colorantes.
Saponificación
Es la sistesis del jabón a partir de la reacción química de aceites o grasas en un medio alcalino, que bien pudiera ser el hidróxido de sodio.
La reacción consiste en la hidrólisis en medio básico de las grasas o lípidos, que se descomponen en sales de potasio o sodio (jabones) y glicerina, como se muestra a continuación:
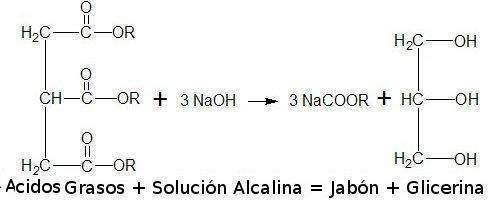
La misma ocurre con desprendimiento de calor, elemento muy necesario para lograr un producto de calidad, por ello mientras mayor sea el calor producido por la reacción mayor calidad tendran los jabones producidos (transparencia y limpieza), aunque esta reacción rara vez produce el calor necesario por lo que se hace muy combeniente suministrarselo para que la neutralización de los ácidos grasos ocurra completamente lograndose así una mayor calidad en el producto.
Los lípidos que pueden intervenir en la reacción son los saponificables que serían aquellos que estén compuestos por un alcohol
unido a uno o varios ácidos grasos (iguales o distintos). Esta unión se
realiza mediante un enlace éster, muy difícil de hidrolizar. Pero puede
romperse fácilmente si el lípido se encuentra en un medio básico. En
este caso se produce la saponificación alcalina.
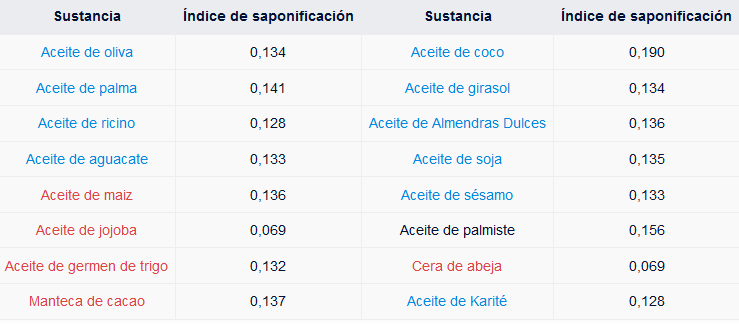
El índice de saponificación es la cantidad en miligramos de un alcali, específicamente de hidróxido de potasio, que se necesita para saponificar un gramo de determinado aceite o grasa. Este varía para cada grasa o aceite en particular. Este dato se obtiene a partir de complejos cálculos, que se simplifican con el uso de tablas existentes.
En estas tablas se registran los índices de saponificación de las
sustancias, es decir la cantidad en miligramos de hidróxido de sodio o
potasio, que necesitan para saponificar cada una de ellas, según la
sustancia utilizada en la obtención del jabón.
A continuación se muestra los índices de saponificación de
algunos de los aceites y grasas, empleados frecuentemente, en la
fabricación de jabones:
Elaboración en laboratorio
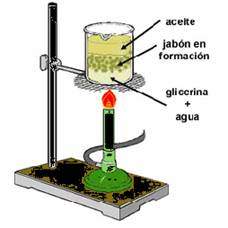
Este proceso puede realizarse a pequeña escala en un laboratorio ya sea con aceites o con grasas:- Con aceite:
- Disolver las perlas de hidróxido de sodio NaOH(sol), para ello pesamos 20 gr de NaOH en la balanza, transferimos el contenido a un matrás aforado de 100 ml y enrasamos con agua destilada para obtener una disolución al 20 %.
- Colocar 100ml de aceite en un recipiente, y lo mezclamos con la disolución de hidróxido de sodio.
- Calentar durante 30 min. aproximadamente, al baño maría con cuidado.
- Dejar reposar durante 24 h a temperatura ambiente, para que se forme el jabón.
- Con grasa animal:
- Disolver las perlas de hidróxido para obtener una disolución al 20 %.
- Pesar 100 gr de grasa animal en la balanza.
- Calentar al baño maría porque se encuentra en estado semisólido debe estar más fluida.
- Luego mezclar con la disolución de hidróxido de sodio y de nuevo calentar la mezcla al baño maría con cuidado.
- Dejar reposar para ver los resultados.
Proceso industrial
La utilización de esta reacción química en la industria esta basada en
dos métodos: por tareas (intermitente) o contínuo. La elección del
procedimiento y de las materias primas dependen de la calidad que se
quiera obtener, de la instalación para el manejo y tratamiento de las
materias primas y de los medios para producir el jabón y recuperar la
glicerina.
La mayor parte de las fábricas de jabón operan por el método de Calderas
de plena cocción con materias grasas neutras. Con este procedimiento se
producen jabones de alta calidad y productos industriales de calidad
inferior y se aprovecha la glicerina.
Algunas formas para la elaboración de jabones a partir de esta reacción química:

- Método de la cocción total: El método de la caldera o de cocción total consta de varios tiempos u operaciones, mediante los cuales se efectúa la saponificación de las materias grasas, la precipitación del jabón en la lejía de jabón concentrada o cola de jabón, la separación de la glicerina y las materias coloreadas de la masa jabonosa por el lavado, y la cocción de acabado para dar el punto a la masa de modo que por el reposo forme un jabón limpio.
- Método continuo con materias grasas neutras: En los últimos años, se han instalado en todo el mundo fábricas de jabón basadas en el proceso continuo. Las fases básicas de fabricación son análogas a las operaciones que se realizan en el método de caldera: Saponificación, lavado del jabón para recuperar la glicerina, acabado. Se opera en contracorriente, y el número de lavados depende de la cantidad de glicerina que ha de ser recuperada del jabón.
- Procedimientos modificados:
- Procedimiento de Semicocción: La materia grasa se mezcla con una cantidad de sosa cáustica suficiente para saponificarla por completo. La reacción se verifica mediante agitación y calentamiento con vapor cerrado. En la masa de jabón se deja la glicerina.
- Procedimiento sin caldera: El calor generado por la reacción exotérmica producida entre las grasas y el álcali se utiliza para llegar a su término la saponificación. La materia grasa se clienta hasta la temperatura conveniente y se mezcla con el álcali cáustico. Si se deja la mezcla en un recipiente aislado en el que la reacción de saponificación se produce lentamente. Este método no produce jabones de alta calidad, porque en las masas de jabón queda algo de materia grasa no saponificada.
- Procedimiento de la Autoclave: El álcali reacciona con la materia grasa a temperatura y presión elevadas. Se agita la mezcla bombeándola con serpentines calentados exotérmicamente. En estas condiciones la saponificación es muy rápida. La masa caliente se somete a expansión instantánea en una cámara de vacío, en la que caen las partículas de jabón, y gran parte de la glicerina y la humedad se eliminan en fase de vapor. La glicerina se condensa de la mezcla de vapores y se recoge. Por razón de la gran temperatura aplicada, los jabones producidos por este método suelen ser mas oscuros. Este método no es de uso general.
- Procedimiento del éster metílico: En estos últimos años se ha trabajado en un procedimiento para hacer jabón transformando en ésteres metílicos los triglicéridos. Estos se tratan con alcohol metílico en presencia de un catalizador. Se separa la glicerina, se destilan los ésteres metílicos y se saponifican con soda cáustica.
- Saponificación en chorros: La materia grasa caliente y la soda cáustica se ajustan de un modo continuo en aberturas anulares de una boquilla por cuya abertura central sale una corriente de vapor que emulsiona la mezcla y la deja caer en una caldera. En ésta se produce la saponificación completa con elevación de temperatura. Los lavados y el acabado se realizan en la forma ordinaria o por método continuo. La saponificación en chorro se emplea mucho en Inglaterra con métodos modificados de lavado y de sedimentación.