LA TERMOQUÍMICA EN PROCESOS ENERGÉTICOS SUSTENTABLES Y LA ELECTROQUÍMICA EN LA PRODUCCIÓN TECNOLÓGICA SOCIOCOMUNITARIA
5. Leyes de Faraday de la electrólisis
Leyes de Faraday de la Electrólisis
Las Leyes de Faraday o Leyes de la Electrólisis son fórmulas que expresan de manera cuantitativa las cantidades depositadas en los electrodos. Estas leyes fueron enunciadas por Michael Faraday en 1834.
1ª Ley de Faraday de la Electrólisis:
La cantidad de masa depositada en un electrodo es proporcional a la cantidad de electricidad que ha circulado por el electrodo:
- masa desprendida = k (constante) · Q = k · I · t
2ª Ley de Faraday de la Electrólisis:
La cantidad de masa depositada de un elemento en un electrodo es proporcional a su peso equivalente (peso atómico dividido entre su número de oxidación):
- masa desprendida = k (constante)· peso atómico / nº oxidación
3ª Ley de Faraday de la Electrólisis:
La cantidad de electricidad que es necesaria para que se deposite 1 equivalente gramo de un elemento es F = 96500 culombios (constante de Faraday). Como 1 equivalente gramo es igual al peso atómico / nº de oxidación en gramos:
donde I es la intensidad en amperios y t el tiempo en segundos. La cantidad de electricidad que es necesaria para que se deposite 1 equivalente gramo de un elemento es F = 96500 culombios (constante de Faraday). Como 1 equivalente gramo es igual al peso atómico / nº de oxidación en gramos:
- masa desprendida = I · t · (peso atómico / nº de oxidación) / 96500
En una electrólisis de 3 disoluciones de CuCl2 , NaCl y FeCl3 , calcular la cantidad de cobre, sodio e hierro que se depositan en los electrodos por el paso de una corriente de 3 Amperios durante 5 minutos.
Solución: En las cubas o celdas electrolíticas las sustancias se encuentran disueltas en iones:
- CuCl2 →
Cu+2 + 2 Cl- - NaCl → Na+ + Cl-
- FeCl3 → Fe+3 + 3 Cl-
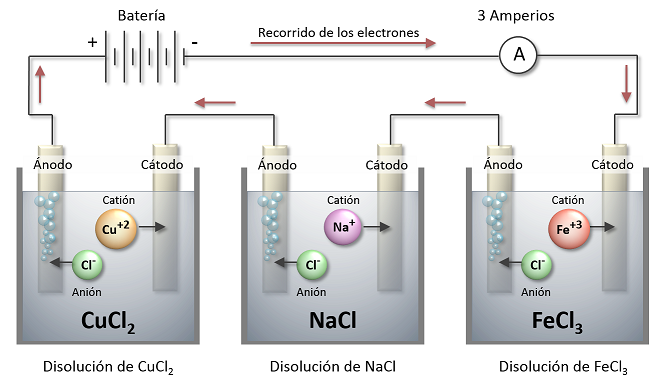
Aplicando la fórmula de la 3ª Ley de Faraday de la Electrólisis obtenemos las masas depositadas en los electrodos negativos (cátodos):
- masa depositada de cobre = [3 amperios · 300 segundos · (65,55 / 2)] / 96500 = 0,3 gramos
- masa depositada de sodio = [3 amperios · 300 segundos · (22,99 / 1)] / 96500 = 0,21 gramos
- masa depositada de hierro = [3 amperios · 300 segundos · (55,84 / 3)] / 96500 = 0,17 gramos