LA TERMOQUÍMICA EN PROCESOS ENERGÉTICOS SUSTENTABLES Y LA ELECTROQUÍMICA EN LA PRODUCCIÓN TECNOLÓGICA SOCIOCOMUNITARIA
1. Energía interna, calor y trabajo en reacciones químicas cotidianas
REACCIONES QUÍMICAS
EN LA NATURALEZA ocurren continuamente cambios químicos que pueden pasar inadvertidos para los que no son especialistas en la disciplina. Difícilmente se puede estar consciente, por ejemplo, de las innumerables reacciones químicas que ocurren en nuestro cuerpo relacionadas con la respiración, el crecimiento, la alimentación, la reproducción, etcétera.
Las plantas verdes, por ejemplo, absorben dióxido de carbono (CO2) de la atmósfera y con la energía proveniente del Sol, el agua y la clorofila (pigmento que les da el color verde), son capaces de producir azúcares y oxígeno libre. Este complicado proceso químico de la naturaleza se llama fotosíntesis.
12 H2O + 6 CO2 ® C6H12O6 + 6 O2 + 6 H2O
Los animales que se alimentan de plantas verdes, ingieren azúcares y otros productos químicos elaborados por las plantas, y de esta manera obtienen la energía que requieren para el desarrollo de sus funciones vitales. Este cambio químico, que ocurre en los animales, devuelve al ambiente agua y dióxido de carbono en la expiración.
La investigación química y el desarrollo tecnológico producen continuamente nuevos materiales: detergentes, colorantes, aromatizantes, conservadores, plásticos, etcétera.
Sin la química no habría automóviles, fotografía, televisores, materiales sintéticos, cosméticos, ni muchas otras cosas que utilizamos diariamente.
Las expectativas de vida se han incrementado gracias a la producción de nuevos fármacos (medicamentos). Muchas enfermedades mortales han sido eliminadas debido al desarrollo de métodos químicos y bioquímicos para su control y desaparición. Actualmente, cientos de profesionales se dedican afanosamente a la búsqueda de remedios y/o vacunas para el síndrome de inmuno deficiencia adquirida.
También es importante reconocer que existen procesos químicos y tecnológicos que conllevan resultados perjudiciales para la salud de los seres vivos, por ejemplo, la contaminación, la producción de basura, los efectos secundarios de algunos pesticidas, etc., que amenazan a nuestro planeta y pueden causar que se vuelva inhabitable.
El conocimiento de las reacciones químicas es importante, no sólo para los especialistas sino también para la sociedad, ya que ayuda a crear una conciencia sana y responsable en la preservación de nuestro medio ambiente y, en términos generales, de la vida en nuestro planeta.
Para poder conocer un poco de estos procesos es necesario ver de manera sencilla aquello que los químicos llaman reacción química.
Ya hemos visto que la materia (sólidos, líquidos y gases)está formada por átomos que a su vez se combinan con otros átomos y moléculas para producir muchas sustancias que conocemos y usamos. En la producción de nuevos compuestos, se absorbe o se desprende calor.
Se llama termoquímica al estudio de los cambios de calor que ocurren durante una reacción química. Ya hemos visto que la cantidad de calor que se transfiere de un sistema a otro se identifica con la letra Q. Cuando en una reacción química el calor ha entrado al sistema, Q es positivo y a la reacción química se le llama endotérmica; si el sistema pierde calor; Q es negativo y la reacción se llama exotérmica.
En la introducción de este libro hemos mencionado el fenómeno de la combustión. La combustión es un caso particular de las reacciones de oxidación en las cuales una sustancia (o elemento) reacciona con el oxígeno. Para ilustrarlo veamos la reacción de oxidación de un metal:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Es bien conocido que si se deja un metal, por tiempo prolongado, expuesto al aire, su superficie se transforma por la formación del óxido. Por ejemplo, los clavos "oxidados" recubiertos de herrumbre. Esta oxidación de la superficie se llama corrosión. En el caso de nuestro ejemplo, la humedad es un factor importante en la aceleración de la formación del óxido de fierro. Por la corrosión, al transcurrir el tiempo, pueden descomponerse o utilizarse maquinarias, transportes, reactores, etc. En nuestro país, la sola corrosión del metal fierro ocasiona pérdidas por millones o billones de pesos.
Los especialistas en corrosión, mediante el estudio de las reacciones químicas, pueden detener y a veces eliminar estos efectos cuando son indeseables.
Algunos metales, como el cinc, níquel, aluminio y el cromo, entre otros, no necesitan ser protegidos de manera especial contra la corrosión, bien sea porque no se oxidan con el aire (el aire contiene 1/5 parte de oxígeno) o porque cuando se forma una capa muy delgada del óxido, éste mismo sirve de protección al resto del material para que no se siga oxidando. Por esta razón se usan como metales protectores de otras superficies más vulnerables a los efectos de la corrosión. Actualmente se usan también materiales plásticos para recubrir y proteger superficies contra estos efectos.
El lenguaje simbólico de la química
En párrafos anteriores escribimos una reacción de oxidación de la siguiente manera:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Para representar esta reacción de manera más económica y hacerla más explícita, se utilizan los símbolos de los elementos y las fórmulas químicas de los compuestos. Tomemos como ejemplo de un metal al mercurio, cuyo símbolo es Hg. La reacción química de oxidación del mercurio se expresaría en el lenguaje de la química:
![]()
Traduzcamos ahora, al lenguaje común, toda la información contenida en esta ecuación química. Primero veremos el significado de la ecuación y más adelante trataremos la información contenida en el recuadro.
Hg es el símbolo del mercurio y proviene del nombre original que se le dio en latín a este elemento: hydrargirium (que en español quiere decir plata líquida). Hg es, por lo tanto, una abreviatura del nombre.
(s) es una abreviatura de la palabra sólido.
(+) este signo, igual al de "suma" en las ecuaciones matemáticas, indica que el mercurio se unirá o combinará con el elemento que sigue a continuación.
(O2) O es el símbolo del oxígeno y el número 2 indica que se trata de una molécula de oxígeno formada por 2 átomos.
(g) indica que el oxígeno está en estado gaseoso.
La flecha sustituye al signo = de nuestra ecuación original simplemente porque la flecha puede hacerse del tamaño que se desea y a veces se puede poner información adicional sobre ella. En realidad no necesita mayor justificación: ¡los químicos la prefieren!
A los elementos a la izquierda de la flecha, en nuestro caso el Hg y el O2, se les suele llamar reactivos, y a los que están en el lado derecho de la flecha, productos. Quizá con esto hemos encontrado una justificación al uso de la flecha; los químicos dicen: "El mercurio al reaccionar con el oxígeno produce óxido de mercurio." Así pues, la flecha está en lugar de la palabra produce, el uso del signo = sería incorrecto, ya que de ninguna manera el mercurio y el oxígeno como elementos son "iguales" al óxido de mercurio, que es un compuesto.
Es importante saber si en una reacción química los productos pueden volver a reaccionar para formar los reactivos originales. Cuando esto sucede, se coloca en la ecuación una segunda flecha en sentido contrario:
A + BEn este caso se dice que la reacción es reversible: puede ocurrir de derecha a izquierda y viceversa. Un ejemplo de una reacción reversible es la del hierro (Fe) con vapor de agua para producir el óxido de hierro 11-111 (Fe3O4) e hidrógeno (H2):
3 Fe + 4 H2O ![]() Fe3 O4 + 4 H2
Fe3 O4 + 4 H2
A + B ![]() C + D,
C + D,
cuando ambas reacciones llegan a un estado en el cual se están formando C y D por reacción de A con B, con la misma rapidez que se combinan C y D para formar nuevamente A y B, se dice que se ha alcanzado un estado de equilibrio dinámico. Este equilibrio es función de la temperatura, de la presión y de las cantidades en exceso de reactivos o productos que puedan estar presentes.
En todas las reacciones químicas ocurren cambios de energía, es decii; se puede absorber o liberar energía en forma de calor, luz, energía eléctrica, etcétera.
Si en una reacción se libera energía en forma de calor; decimos que la reacción es exotérmica; si la energía es absorbida, entonces la reacción es endotérmica.
La manera de expresar esto en el lenguaje de las reacciones químicas es mediante el símbolo DH (cambio de entalpía), que precedido de un signo negativo (-DH) indica que la energía es liberada; otra forma de expresar lo mismo es DH < O, esto es, que DH es menor que cero. Si en la reacción se absorbe energía, se antepone un signo + (+DH) o bien en su forma equivalente DH > O (DH es mayor que cero).
Ejemplos:
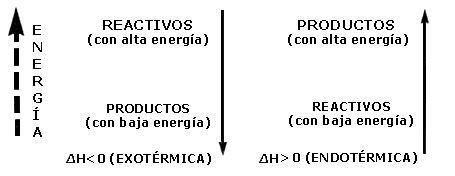
El símbolo H representa la entalpía del sistema y es una función con propiedades semejantes a la energía interna (U). Cuando los procesos se llevan a cabo a presión constante, es más conveniente utilizar la función entalpía.3
Un ejemplo de una reacción exotérmica común es la combustión del gas natural:
CH4(g) + 2 O2(g) => CO2(g) + 2H2O(l); DH < 0
Se obtienen unas 13 300 calorías por cada gramo de metano (CH4) quemado.
Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, donde las radiaciones ultravioleta proveen la energía del Sol. También ocurre cerca de descargas eléctricas (cuando se producen tormentas eléctricas):
El olor del ozono puede usted reconocerlo aun en pequeñas cantidades, por ejemplo: cuando un tren eléctrico de juguete está en operación y saltan chispas. Es un olor
ENERGÍA INTERNA ( U ).Energía interna es la energía total de los componentes de un sistema y es la suma de todos los tipos de energía que puedan tener los componentes de dicho sistema: energías de los enlaces, de traslación y rotación de las moléculas, vibración de los átomos, etc. La energía interna es una función de estado que se representa por la letra U. Es por definición imposible de calcular el valor absoluto para un sistema en un estado determinado, solo se puede afirma que depende de la temperatura a la que se encuentra siendo mayor la energía interna del sistema cuanto mayor es la temperatura a la que se encuentra. Pero si se puede calcular la variación entre dos estados
CALOR DE REACCIÓN ( Q ).
Es el calor absorbido o desprendido en un proceso o reacción química. Por
convenio, se le asigna signo positivo si fluye del entorno al sistema y negativo si va
del sistema al entorno.
Si el proceso químico conlleva una absorción de energía del sistema en forma
de calor se llama endotérmico. Y si la cede exotérmico.