EQUILIBRIO QUÍMICO EN LAS REACCIONES COTIDIANAS DE INTERÉS TECNOLÓGICO Y EL EQUILIBRIO IÓNICO PRODUCTO DE SOLUBILIDAD EN EL ANÁLISIS DEL AGUA PARA CONSUMO HUMANO
6. Autoionización del agua y cálculos de pH
Autoionización del agua y cálculos de pH
Medidas de conductividad indican que el agua pura está parcialmente ionizada. Los iones se generan cuando unas moléculas de agua actúan como ácidos cediendo protones a otras moléculas de agua que actúan como bases, según el siguiente equilibrio.![]()
Se trata de una reacción reversible muy desplazada hacia la izquierda. Las cantidades de iones oxonio e hidróxido presentes en el medio es muy pequeña.
La constante de equilibrio de esta reacción se denomina producto iónico del agua,
![]()
En el agua pura las concentraciones de ambos iones es igual: ![]()
Dado que Kw es una constante, en todo momento el producto de las concentraciones de iones oxonio e hidróxido debe ser 10−14.
Por tanto, si añadimos al agua pura un ácido aumentando la
concentración de protones de la disolución, la concentración de iones
hidróxido debe disminuir para mantener el valor de K
Escala de pH
En 1909, el químico danés Soren Sorensen definió el pH como:
![]()
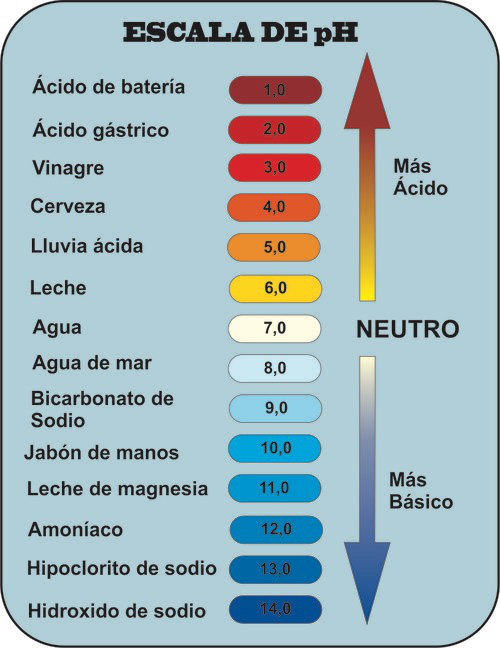
El pH nos da el grado de acidez que presenta una disolución.
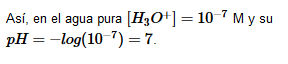
- De modo que consideramos que todas las disoluciones acuosas a 25ºC con pH=7 son neutras.
- Cuando el pH es mayor de 7 la disolución es básica.
- Cuando el pH es menor de 7 la disolución es ácida.
También podemos definir el pOH:
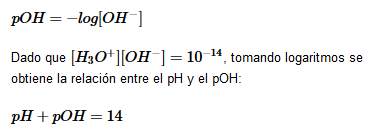
Ver más sobre autoionización del algua y calculos del pH...