EQUILIBRIO QUÍMICO EN LAS REACCIONES COTIDIANAS DE INTERÉS TECNOLÓGICO Y EL EQUILIBRIO IÓNICO PRODUCTO DE SOLUBILIDAD EN EL ANÁLISIS DEL AGUA PARA CONSUMO HUMANO
7. Titulación de ácidos y bases de uso cotidiano
¿Cómo se lleva a cabo una titulación ácido-base? La titulación, o también conocida como valoración,
tiene como objetivo determinar la concentración de una disolución ácida
o básica, llamada disolución analizada o muestra problema. Esto se
logra adicionando pequeños volúmenes de una disolución de concentración
conocida, llamada disolución valorada.
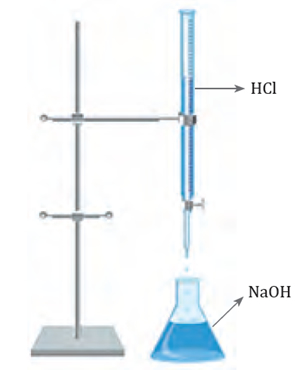
El proceso de titulación se
basa en la neutralización que se lleva a cabo entre la disolución ácida y
la básica. De esta manera, si se conoce la concentración de iones H+ de la disolución valorada, se puede inferir la concentración de iones OH- de la disolución analizada. Esto se calcula a partir del volumen de disolución valorada utilizado. En el momento en el que la concentración de H+ y OH- se igualan, se dice que se ha alcanzado el punto de equivalencia.
Para determinar este punto, se utiliza un indicador que se caracteriza
porque tiene colores diferentes en medio ácido y en medio básico. El
punto en que cambia el color de un indicador se llama punto final. Por ende, es necesario elegir un indicador cuyo punto final corresponda o se acerque lo más posible al punto de equivalencia. El proceso de titulación se representa gráficamente mediante una curva de valoración.
Para graficarla es necesario saber el pH de la disolución analizada
(eje Y) luego de la adición de pequeñas cantidades de volumen de la
disolución valorada (eje X)
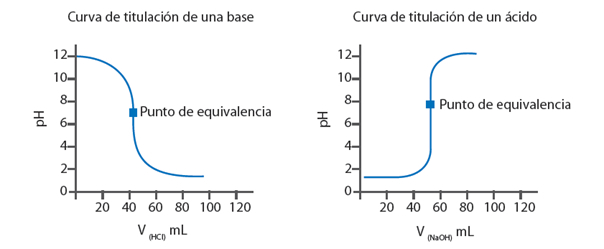

Por ejemplo, al titular 25 mL
de NaOH de concentración 0,5M con HCl 0,5M del cual se disponen 10 mL,
se debe conocer en primer lugar la cantidad de moles de cada sustancia,
teniendo en consideración que los moles son iguales a la concentración
molar por el volumen de solución. Para determinar los moles de H+ se debe considerar que: Moles H+ = Concentración de ácido x Volumen de ácido Moles H+ = 0,5 mol/L x 0,01 L = 5 x 10-3 mol Mientras que, para determinar los moles de OH-, se debe tener en cuenta que: Moles OH- = Concentración de base x Volumen de base Moles OH- = 0,5 mol/L x 0,025 L = 0,0125 mol En este caso, considerando que los moles de ácido son menores que los
moles de la base, se debe poner la base en la bureta y el ácido en el
matraz. Por lo tanto, el pH de la muestra dependerá solo del ácido,
cuando el volumen de la base sea igual a 0 mL. En este caso, el pH será
igual a: pH = -log 5 x 10-3 pH = 2,30 Al agregar base a la solución, por ejemplo 1 mL, se añade en el
matraz una cantidad de moles específica que se calcula de la siguiente
forma: Si se añade 1 mL de base, los moles que se agregan a la muestra están dados por: moles de OH- = Concentración de base x Volumen de base moles de OH- = 0,5 mol/L x 0,001 L = 5 x 10-4 mol Estos moles de OH- reaccionan con los moles de H+
presentes en el matraz formando agua. Por lo tanto, a los moles de
ácido que inicialmente se tenían en el matraz, se le debe restar el
ácido añadido, ya que estos, han neutralizado su efecto. Moles de H+ = 5 x 10-3 mol – 5 x 10-4 mol = 4,5 x 10-3 mol Al añadir 1 mL a la muestra, ahora la cantidad total de la muestra
será 11 mL, por lo tanto, la nueva concentración de la muestra estará
dado por: Concentración de ácido = moles de H+/Volumen de la muestra Concentración de ácido = 4,5 x 10-3 mol / 0,011 L = 0,409 mol/L A partir de esto, es posible, conocer el pH de la muestra, luego de haber añadido la base, lo que estará dado por: pH = -log 4,5 x 10-3 pH = 2,35 Por lo tanto, luego de añadir 1 mL de base a la muestra, la disolución aumento su pH Más información sobre titulación acido-base.....