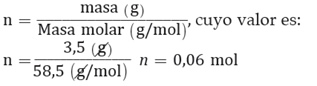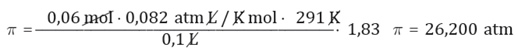DISOLUCIONES, PROPIEDADES COLIGATIVAS Y SU USO COTIDIANO EN LA COMUNIDAD
3. Propiedades coligativas de las disoluciones y factores de solubilidad
1.- ¿Cómo se relaciona el grado de disociación de un soluto con la conductividad de ésta?
El soluto, sustancia que se encuentra en menor proporción en una disolución, puede ser de tipo iónico o molecular, lo que hace, que en algunos casos, las disoluciones conduzcan la corriente eléctrica, y en otros casos no.
Clasificación de solutos conductores y no conductores de la electricidad.
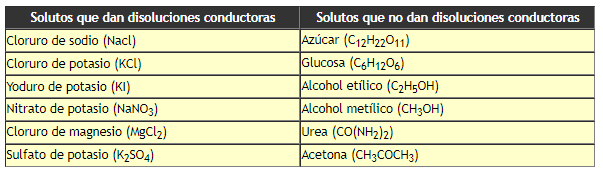
Los solutos que son capaces de generar disoluciones conductoras, se denominan electrolitos, y los solutos que no forman disoluciones conductoras de la corriente eléctrica se denominan no electrolitos.
Por otra parte, el comportamiento del soluto, también se ve influenciado por el disolvente en el cual se encuentra, ya que, por ejemplo, si se disuelve cloruro de sodio en agua, la disolución conduce la corriente, pero si se disuelve en benceno, la disolución no la conducirá.
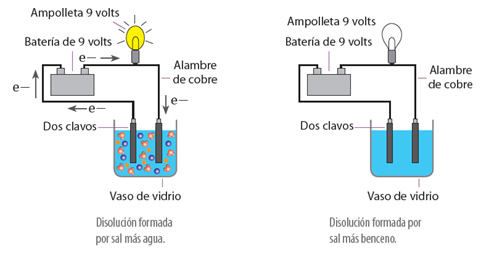
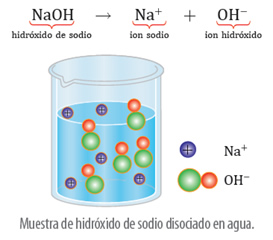
Esto sucede porque el cloruro de sodio en agua se disocia en iones cloruro (Cl-) y en iones sodio (Na+), ya que, el agua es un disolvente de naturaleza polar, es decir, presenta un polo positivo y otro negativo, por lo cual, al desplazarse por un conductor produce corriente eléctrica. En cambio, en el caso del benceno, que es un compuesto apolar, que presenta cargas simétricas, impide el desplazamiento de las cargas a través del conductor, por lo que no se genera la conducción.
Svante Arrhenius, en el 1887, fue quien explicó la conductividad eléctrica de las disoluciones, a través de su teoría de la disociación electrolítica.
Esta teoría indica que los electrolitos, en disolución o fundidos, se disocian en iones con carga eléctrica, de manera que la carga total sobre los cationes es igual a la carga total sobre los aniones. Por lo tanto, la disolución en conjunto será neutra.
Además, los iones son los átomos o grupos de átomos que forman los electrolitos. Los no metales forman iones negativos y los metales iones positivos.
Por ejemplo, la disociación del ácido clorhídrico, es:

La disociación del hidróxido de sodio, es:
Otras expresiones de la disociación iónica son:

Que una disolución sea mejor o peor conductora, depende de la presencia de una gran cantidad de iones provenientes de la disociación total o casi completa del electrolito. Los solutos que producen disoluciones muy conductoras se denominan electrolitos fuertes, y las que producen disoluciones de baja conductividad se llaman electrolitos débiles, ya que la disociación es parcial. Es posible determinar el porcentaje de disociación de un electrolito en una disolución midiendo la conductividad eléctrica de la disolución o midiendo el descenso en el punto de congelación de la disolución.
Por ejemplo, si una disolución 0,1 molal de cloruro de sodio, presenta un descenso del punto de congelación de 0,34 °C, sin embargo, si fuese un compuesto que no sufriera disociación, la variación debería ser de 0,19 °C. Por otra parte, si el cloruro de sodio se disocia completamente, es decir, si un mol del compuesto genera dos moles de iones, la variación de la temperatura es de 0,38 °C. Por lo tanto, la disociación del cloruro de sodio, en esta disolución, no es total, por lo que, hay un número elevado de moléculas del compuesto que no se disocian. Ahora, para saber el porcentaje de disociación de la disolución, se debe tener en cuenta que cuando corresponde a 0% la variación es de 0,19°C, y cuando es 100%, la variación es de 0,38 °C, pudiendo hacer la siguiente relación, sabiendo que la temperatura experimental de la disolución con la que se trabaja es de 0,34 °C:
El cálculo del valor de X se obtiene por las diferencias entre los porcentajes y las variaciones de temperatura:
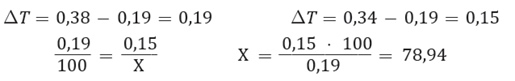
Por lo tanto, el cloruro de sodio en una disolución 0,1 molal se disocia en un 78,94%
Ahora, para poder determinar el porcentaje de disociación del cloruro de calcio en una disolución 0,075 molal que se congela a -0,32 °C, sabiendo que cuando no existe disociación la temperatura es igual 0,12 °C y cuando alcanza el 100% de disociación es 0,36°C, se deben seguir los siguientes pasos:
- En primer lugar, se deben determinar los datos a partir del enunciado:
- Sabiendo que la variación de temperatura de la disolución es -0,32°C y que el porcentaje de disociación del soluto está comprendido entre 0 y 100, se puede plantear la siguiente relación:
- Para despejar la X, se debe considerar las diferencias entre los porcentajes y las variaciones de temperatura:
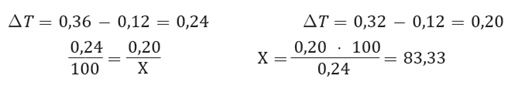
- Es posible concluir, que el cloruro de calcio en una disolución 0,075 molal se disocia un 83,33%
Generalmente, se designa como electrolitos débiles a aquellos electrolitos cuyo porcentaje de disociación es inferior a 10%, y como electrolitos fuertes a aquellos cuyo grado de disociación es igual o mayor a 40%.
2.- ¿Qué propiedades tienen las disoluciones?
Cuando un soluto y un disolvente dan origen a una disolución, la presencia del soluto determina una modificación de las propiedades que presenta el disolvente en estado puro, las que dan origen a las propiedades de la disolución, que pueden ser constitutivas o coligativas.
Las propiedades constitutivas son aquellas que dependen de la naturaleza de las partículas disueltas, por ejemplo, la viscosidad, la densidad, la conductividad eléctrica.
Por otra parte, las propiedades coligativas son aquellas que dependen del número de partículas disueltas en una cantidad fija de disolvente, es decir, la concentración de soluto, y no de la naturaleza de estas partículas. Son propiedades coligativas el descenso en la presión de vapor del disolvente, el aumento del punto de ebullición, la disminución del punto de congelación y la presión osmótica.
Se debe tener en consideración, al trabajar con las propiedades coligativas, que la concentración de la disolución no debe ser mayor a 0,2M, pues, teóricamente las fuerzas de atracción intermolecular entre soluto y disolvente serán mínimas, y no generaran errores.
3.- ¿Qué es la presión de vapor y cómo se relaciona con las disoluciones?
Los líquidos tienen la capacidad de evaporarse, es decir, las partículas de la superficie del líquido tienden a salir de la fase líquida en forma de vapor. La presión que ejercen estas partículas que salen de la superficie y que chocan con la superficie del líquido por unidad de área se denomina presión de vapor
La presión de vapor varía según el líquido, dado que, las fuerzas de atracción entre sus moléculas tendrán su presión de vapor característica, además, ésta dependerá de la temperatura y de la naturaleza del líquido:
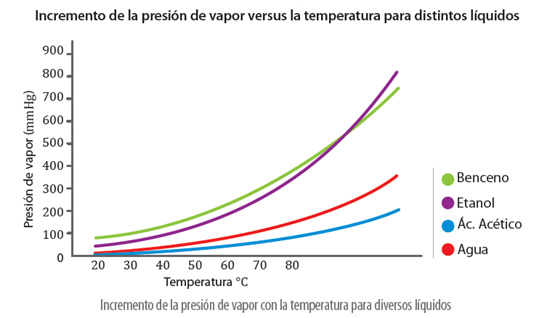
La presión de vapor aumenta con la temperatura, ya que, a medida que aumenta la temperatura, la energía cinética de las partículas aumenta, por lo que mayor cantidad de moléculas en estado gaseoso salen de la superficie del líquido ejerciendo mayor presión sobre él.
Por otra parte, líquidos que tienen una alta presión de vapor reciben el nombre de volátiles, como por ejemplo, el benceno y el etanol, y aquellos que presentan baja presión de vapor se denominan no volátiles, como el agua.
Ahora, una disolución que contiene líquidos no volátiles o solutos en estado sólido, va a presentar una presión de vapor más baja que el disolvente puro que la forma. Esto ocurre, porque cuando un soluto no volátil se disuelve en un líquido, parte del volumen total de la disolución es ocupado por moléculas de soluto, por lo tanto, hay menos moléculas de disolvente por unidad de área en la superficie, lo que origina el descenso de la presión de vapor del disolvente.
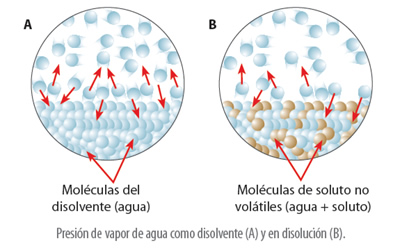
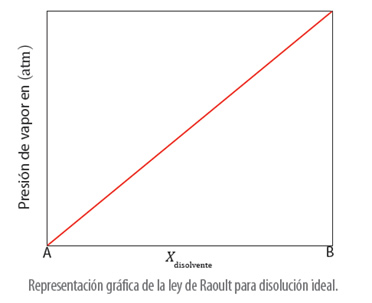
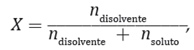
Este descenso de la presión de vapor por la presencia de solutos no volátiles se presenta en la Ley de Raoult, que dice que “la presión de vapor de un disolvente en una disolución es igual a la presión de vapor del disolvente puro multiplicada por la fracción molar del mismo en la disolución”. Expresado matemáticamente se puede decir que:
P = X disolvente • P disolvente puro
Xdisolvente corresponde a la fracción molar del disolvente en la disolución, es decir, la proporción de moles de disolvente que hay en el total de moles de disolución; y, P°disolvente puro es la presión de vapor del disolvente puro y P es la presión de vapor del disolvente en la disolución.
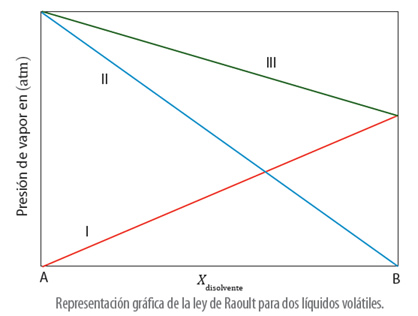
En el caso, de que una disolución esté formada por un soluto volátil, en la ley de Raoult, se sigue considerando que se tienen dos componentes, denominados A y B, que corresponden a las presiones del soluto y las presiones del disolvente:
![]()
Por lo tanto, como el soluto y el disolvente tienen una presión de vapor, la presión total del sistema será igual a la suma de las presiones parciales de cada componente:
![]()
La gráfica que muestra la ley de Raoult usando dos especies volátiles es:
Por ejemplo, para poder determinar la masa molar de un soluto que forma una determina disolución, sabiendo que la presión de vapor del agua pura a 25 °C es 23,76 mm de Hg, y la presión de vapor de una mezcla formada por 5,4 g de soluto no volátil en 90 g de agua es 23,32 mm de Hg, se deben seguir los siguientes pasos:
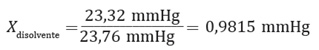
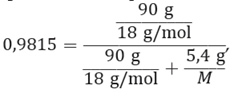
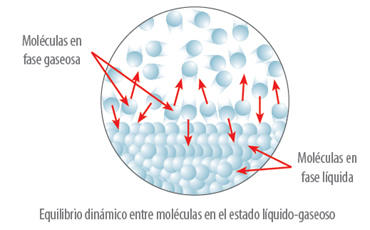
Al añadir un soluto a un disolvente, formando una disolución, el disolvente tiene un menor número de partículas que pasan al estado gaseoso, debido a la acción de las moléculas del soluto en la superficie, que lo evitan.
Esto provoca, un aumento en el punto de ebullición, ya que, la presión de vapor se igualará a la presión atmosférica a mayor temperatura.
Variación del punto de ebullición en función del aumento de la concentración de la disolución.
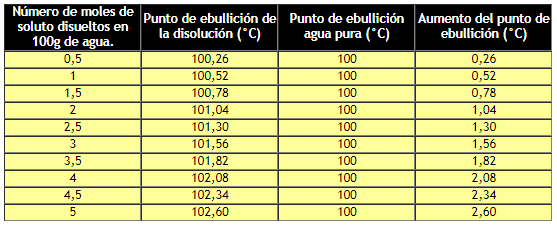
Si se grafican los datos anteriores, se tiene:
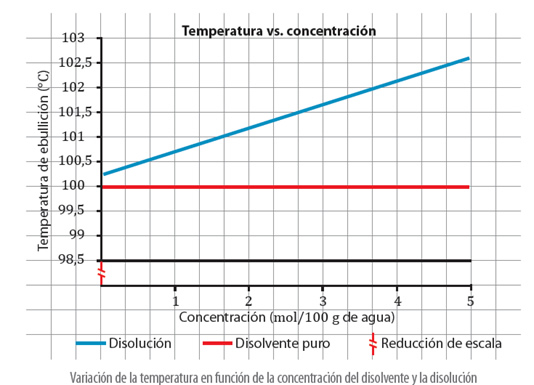


La disminución del punto de congelación de una disolución es proporcional a la concentración de la disolución, lo que se expresa de la siguiente manera:
![]()
De esta forma, m, corresponde a la concentración molal de la disolución, y Kf es la constante molal de la disminución del punto de congelación, valores conocidos y tabulados para cada disolvente.
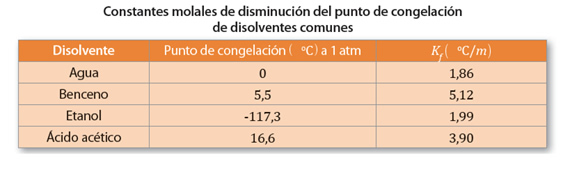
Ahora, el punto de congelación es menor en una disolución que cuando se tiene un disolvente puro, porque, al pasar de un estado líquido a uno sólido, el sistema se va ordenando, liberando energía cuando esto ocurre, y como en una disolución hay mayor desorden que en el disolvente puro, se requiere que se libere más energía para lograr el orden, por lo tanto, se tiene un menor punto de congelación.
Ahora, para poder saber el punto de congelación de una disolución que se ha preparado disolviendo 100 g de anticongelante etilenglicol en 900 g de agua, sabiendo que la constante molal de disminución del punto de congelación del agua es 1,86 °C/m, y que la masa molar del etilenglicol es 62 g/mol, se debe tener en consideración que:
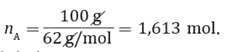
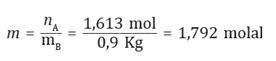
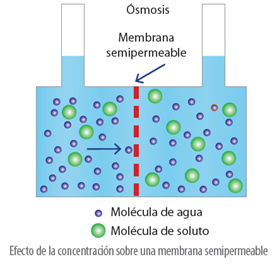
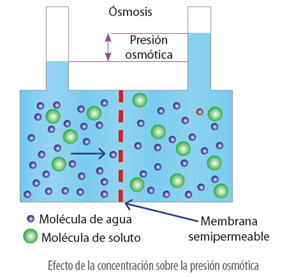
Esta diferencia de niveles de ambas disoluciones, genera una presión, denominada presión osmótica.
La presión osmótica es la presión necesaria para detener el flujo de disolvente a través de la membrana semipermeable que separa las dos disoluciones de diferentes concentraciones.
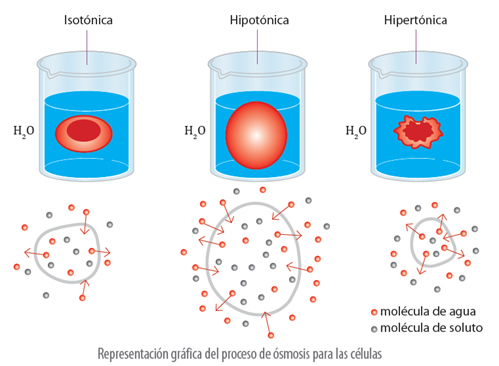
Las disoluciones, según la concentración que presenten, se pueden clasificar como isotónicas, hipertónicas e hipotónicas.
Las disoluciones isotónicas son aquellas que presentan igual concentración e igual presión osmótica. Las disoluciones hipertónicas son disoluciones que presentan diferentes presiones osmóticas y diferentes concentraciones, por lo que la disolución más concentrada se encuentra en el medio externo. Y, las disoluciones hipotónicas, son disoluciones que presentan diferentes presiones osmóticas y diferentes concentraciones, siendo la de menor concentración la que se encuentra en el medio externo.
El proceso de osmosis es muy fácil de visualizar en las células. Por ejemplo, cuando una célula se encuentra en una disolución cuya concentración es igual tanto fuera como dentro de ella, se dice que el líquido es isotónico, ya que, no hay intercambio a través de la membrana celular. Si en el medio exterior hay mayor concentración que en el interior de la célula, se dice que hay un líquido hipertónico, y las moléculas de agua pasan de la célula al exterior a través de la membrana plasmática, y la célula se contrae. Finalmente, si la célula se encuentra en un medio formado por una disolución de menor concentración que el interior de ella, se tiene un líquido hipotónico, produciéndose el paso de moléculas de agua hacia el interior de la célula, por lo que, la célula se hincha.
La presión osmótica obedece a una ley similar a la de los gases ideales. Esto se expresa a través de una ecuación, denominada la Ecuación de Van’t Hoff.
![]()
π corresponde a la presión osmótica, V es el volumen de la disolución, R es la constante de los gases ideales, que corresponde a 0,082 L atm/K mol, n es el números de moles de soluto y T es la temperatura en grados K.
De la ecuación de Van’t Hoff se deduce que a temperatura constante la presión osmótica solo depende del número de la concentración de partículas y no de la naturaleza de este, es por eso, que es una propiedad coligativa
Si el volumen de la disolución se trabaja en litros, sabiendo que la molaridad corresponde a los moles de soluto dividido en el volumen de disolución en litros, se tiene que:
π = M R T
Ahora, para conocerla concentración de glucosa que será isotónica con la sangre, sabiendo que la presión osmótica promedio de la sangre a 25 °C es 7,7 atm, se deben seguir los siguientes pasos:

7.- ¿Qué propiedades tienen las disoluciones formadas por electrolitos?
Si se compara el valor del punto de congelación de una disolución formada por un electrolito, como por ejemplo el cloruro de sodio, con otra formada por un no electrolito, como la sacarosa, se puede verificar que en el primer caso, la variación es el doble, que si se utiliza un no electrolito.
Disminución del punto de congelación de disoluciones de electrólito y no electrólito

Esto sucede porque un electrolito al disociarse forma partículas con carga eléctrica que se mueven dentro de la disolución. Estos iones con cargas opuestos chocan y se unen por breves momentos. Cuando se unen, los iones se comportan como una sola partícula, denominada par iónico, siendo el número de partículas libres limitado, lo que se demuestra en la disminución de la concentración molal de la disolución, y por lo tanto, en la disminución del punto de congelación, o en una elevación del punto de ebullición, o la disminución de la presión de vapor y la modificación de la presión osmótica.
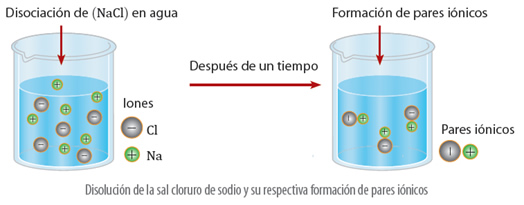
Este fenómeno, fue estudiado por Van’t Hoff, y él propuso que para demostrar los efectos que producen los electrolitos sobre las propiedades coligativas, debo utilizarse la siguiente expresión:
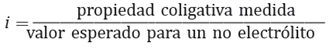
En este caso i, es el factor de Van’t Hoff, que indica el número de moles de que se producen cuando un mol de sustancia se disocia.
También, este factor puede determinarse, al observar la especie. Por ejemplo:

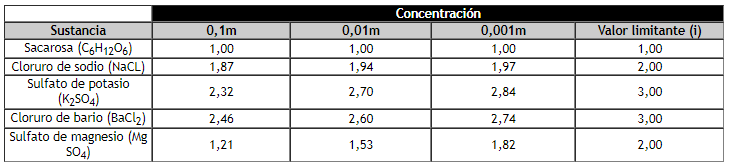
Se han tabulado los valores del factor de Van’t Hoff para varias sustancias a diferentes concentraciones.
Factores de van’t Hoff para diversas sustancias a 25°C
Por lo tanto, aplicando el coeficiente de Van’t Hoff a las expresiones de las propiedades coligativas, se tiene que estas corresponderán a:
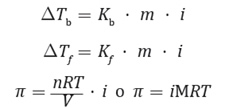
Ahora, para determinar la presión osmótica a 18 °C de una disolución acuosa de cloruro de sodio que contiene 3,5 g de sal en 100 mL de disolución, conociendo que el factor de Van’t Hoff es 1,83 y la masa molar del cloruro de sodio es 58,5 g/mol, se deben tener en consideración que: