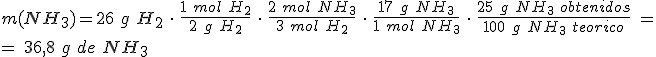CONSERVACIÓN DE LA MATERIA EN LOS PROCESOS SOCIOPRODUCTIVOS
3. Rendimiento de una reacción en procesos productivos.
En general, cuando se produce una reacción química se obtienen menores cantidades de producto de las que cabria esperar teóricamente por la estequiometría de la reacción.
Los motivos son diversos, como por ejemplo:
- La reacción se produce en condiciones inadecuadas.
- Se pierde algo de la sustancia al manipularla.
- Existen reacciones alternativas o secundarias que dan lugar a productos no deseados.
Además, hay muchos casos en los que la conversión de reactivos en productos no es total por razones energéticas, independientemente de que se den las circunstancias anteriores.

Rendimiento de una reacción
Se define el rendimiento de una reacción química como:
![]()
Ahora vas a tener en cuenta el rendimiento en una reacción concreta.
Un método usado para reducir emisiones de cloruro de hidrógeno, que fue utilizado para obtener cloro antes de los procesos electrolíticos es la oxidación directa del HCl con el oxígeno, con el empleo de un catalizador y a alta temperatura.
La ecuación química ajustada del proceso es:
4 HCl + O2 → 2 Cl2 + 2 H2O
Partiendo de 27 g de HCl y con suficiente oxígeno, ¿cuál es la masa de Cl2 que obtendrás si el rendimiento de la reacción es del 36 %?
La secuencia de operaciones incluirá un factor que tenga en cuenta el rendimiento de la reacción:
Escribe la ecuación química ajustada: N2 + 3 H2 → 2 NH3
Calcula las masas molares de los reactivos y producto: M(N2) = 28 g/mol ; M(H2) = 2 g/mol ; M(NH3) = 17 g/mol.
Las cantidades de sustancia iniciales son:
La proporción estequiométrica indica que: 1 mol de N2 / 3 mol de H2 = 5 mol de N2 / n(H2)
n(H2) = 15 mol de H2
15 > 13 y el reactivo limitante es el H2
Para calcular la masa de NH3 debes partir de la masa del reactivo limitante, el H2.