CONSERVACIÓN DE LA MATERIA EN LOS PROCESOS SOCIOPRODUCTIVOS
1. Ley de la conservación de la materia en las reacciones químicas
Ley de conservación de la materia

La ley de conservación de la materia, conocida también como ley de conservación de la masa o simplemente como ley Lomonósov-Lavoisier (en honor a los científicos que la postularon), es aquel principio de la química que plantea que la materia no se crea ni se destruye durante una reacción química, sólo se transformado.
Este principio fundamental de las ciencias naturales fue postulado por dos científicos de manera simultánea e independiente: el ruso Mijaíl Lomonósov en 1748 y el francés Antoine Lavoisier en 1785. Llama la atención que esto ocurriera antes del descubrimiento del átomo y la postulación de la teoría atómica, con la cual es mucho más sencillo explicar e ilustrar el fenómeno.
La excepción a la regla la constituyen las reacciones nucleares, en las que es posible convertir masa en energía y viceversa, pudiendo “crearlas” y “destruirlas” a conveniencia, aunque realmente se esté transformando materia en energía y viceversa.
Junto a la equivalencia entre masa y energía, la ley de la conservación de la materia fue clave para la comprensión de la química contemporánea.
| Concepto: | En toda reacción química la masa se conserva, es decir, la masa total de los reactivos es igual a la masa total de los productos. |
Antecedentes de la Ley de conservación de la materia
La química de aquellos años entendía los procesos de reacción de manera muy distinta a la actual, en algunos casos llegando a afirmar lo contrario a lo que plantea esta ley.
Los experimentos de Robert Boyle en el siglo XVII, pesando distintos metales antes y después de dejarlos oxidar, atribuía el cambio en el peso a la ganancia de materia, ignorando que el óxido significaba la extracción de átomos de oxígeno del aire por parte del metal.
Descubrimiento de la Ley de conservación de la materia
Las experiencias que llevaron a Lavoisier al descubrimiento de este principio tienen que ver con uno de los principales intereses de la química de la época, como fue la combustión. Calentando diversos metales, el francés se dio cuenta de que éstos ganaban masa al calcinarse si se dejaban expuestos al aire, pero que su masa permanecía idéntica si estaban en envases cerrados.
Así, dedujo que esa cantidad extra de masa provenía de algún lado, y pudo proponer su teoría de que no era creada, sino tomada del aire. Por ende, en condiciones controladas, puede medirse la cantidad de masa de los reactivos antes del proceso químico y la cantidad de masa posterior, debiendo ser necesariamente idénticas, aunque ya no lo sea la naturaleza de los productos.
Ejemplo de la Ley de conservación de la materia
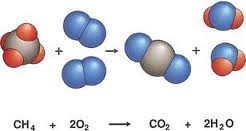
Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y “desaparecer”, cuando en verdad se habrá transformado en gases invisibles y en energía liberada.
Por ejemplo, al quemar metano (CH4) tendremos la siguiente reacción, cuyos subproductos serán gaseosos e invisibles, pero de una cantidad de átomos idéntica:
CH4 + 2O2 (del aire) CO2 + 2H2O (vapor de agua) + energía