FUERZAS DE UNIÓN Y ENLACE QUÍMICO EN LA MADRE TIERRA
5. Estructura de Lewis
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis, representación de Lewis o fórmula de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante, estable y relativa. En esta fórmula se muestran enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente indicando la ordenación de los átomos en el espacio. Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y después de cada uno de estos se encuentran en cada enlace covalente.
Las estructuras de Lewis muestran los diferentes átomos de una determinada causa usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. Representan también si entre los átomos existen enlaces simples, dobles o triples. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones apartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
Este modelo fue propuesto por Gilbert Newton Lewis quién lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
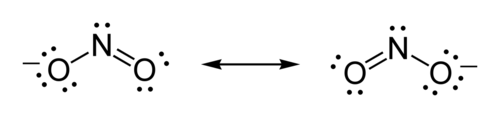
Ejemplo: Estructura de Lewis para el ion nitrito
La fórmula del ion de nitrito es :NO2-
- Paso uno: Escoger el átomo central. Existe sólo un átomo de nitrógeno, y es el átomo con más electronegatividad, por lo que éste se convertirá en nuestro átomo central.
- Paso dos: Contar los electrones de valencia. El nitrógeno posee 5 electrones de valencia; cada oxígeno posee 6, para un total de (6 × 2) + 5 = 17. El ion posee una carga de –1, lo que nos indica un electrón extra, por lo que el número total de electrones es de 18.
- Paso tres: Ubicar los pares electrónicos. Cada oxígeno debe ser enlazado al nitrógeno, que usa cuatro electrones, dos en cada enlace. Los 14 electrones restantes deben ser ubicados inicialmente como 7 pares solitarios. Cada oxígeno debe tomar un máximo de 3 pares solitarios, dándole a cada oxígeno 8 electrones, incluyendo el par del enlace. El séptimo par solitario debe ser ubicado en el átomo de nitrógeno.
- Paso cuatro: Cumplir la regla del octeto. Ambos átomos de oxígeno poseen 8 electrones asignados a ellos. El átomo de nitrógeno posee sólo 6 electrones asignados. Uno de los pares solitarios de uno de manera simple con el átomo de nitrógeno. Ponga los corchetes alrededor de cada estructura, y escriba la carga ( - ) en el rincón superior derecho afuera de los corchetes. Dibuje una flecha doble entre las dos formas de resonancia.